Содержание
- 2. Цель урока: Обобщить и систематизировать знания о типах химических реакций.
- 3. Без химических реакций невозможна жизнь и всё многообразие веществ.
- 4. Изменение окраски Появление запаха Образование (растворение) осадка Выделение газа Выделение или поглощение энергии
- 5. Ситуация №1 Мама решила побелить квартиру, пошла в магазин за известью, а её там не оказалось.
- 6. . СОЕДИНЕНИЯ 1. АВ + СД = АД + СВ ЗАМЕЩЕНИЯ 2. А + В =
- 7. . СОЕДИНЕНИЯ 1. АВ + СД = АД + СВ ЗАМЕЩЕНИЯ 2. А + В =
- 8. Ситуация №2 Чтобы запаять чайник, папе для обработки поверхности металла понадобилась «травленая» соляная кислота. Для её
- 9. . СОЕДИНЕНИЯ 1. АВ + СД = АД + СВ ЗАМЕЩЕНИЯ 2. А + В =
- 10. . СОЕДИНЕНИЯ 1. АВ + СД = АД + СВ ЗАМЕЩЕНИЯ 2. А + В =
- 11. Ситуация №3 Члены кружка «Юный химик» помогали учителю готовить на следующий урок лабораторную работу. Случайно капля
- 12. . СОЕДИНЕНИЯ 1. АВ + СД = АД + СВ ЗАМЕЩЕНИЯ 2. А + В =
- 13. . СОЕДИНЕНИЯ 1. АВ + СД = АД + СВ ЗАМЕЩЕНИЯ 2. А + В =
- 14. Ситуация №4 Светлана Леонидовна получила осадок гидроксида меди (II)(Сu(OH)2( при взаимодействии раствора сульфата меди (СuSO4) и
- 15. . СОЕДИНЕНИЯ 1. АВ + СД = АД + СВ ЗАМЕЩЕНИЯ 2. А + В =
- 16. . СОЕДИНЕНИЯ 1. АВ + СД = АД + СВ ЗАМЕЩЕНИЯ 2. А + В =
- 17. вариант №1 вариант №2 часть А 1.Б 2.Б 3.А часть Б А) 4 Li + O2
- 18. 10 - 12 баллов «5» 8 - 9 баллов «4» 6 - 7 баллов «3»
- 20. Скачать презентацию
















 Алкадиены. Физические свойства
Алкадиены. Физические свойства Способы разделения смесей. Урок в 8 классе
Способы разделения смесей. Урок в 8 классе Применение муравьиного спирта
Применение муравьиного спирта Алкены. Строение
Алкены. Строение Халькогены. Электронное строение кислорода и серы
Халькогены. Электронное строение кислорода и серы Наполнители для пластмасс
Наполнители для пластмасс Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс
Спирты. Классификация, номенклатура, изомерия, получение и применение. 10 класс Электролитическая диссоциация
Электролитическая диссоциация Презентация на тему Природные источники углеводородов
Презентация на тему Природные источники углеводородов  Металлы в организме человека
Металлы в организме человека Основания. Структурная формула
Основания. Структурная формула Угольная кислота и ее соли
Угольная кислота и ее соли Органическая химия. Ароматические углеводороды
Органическая химия. Ароматические углеводороды Инертные газы и перспективы их применения
Инертные газы и перспективы их применения Способы защиты химического оборудования от коррозии
Способы защиты химического оборудования от коррозии Teksta uzdevumi (1)
Teksta uzdevumi (1) Мышьяк. История. Нахождение в природе
Мышьяк. История. Нахождение в природе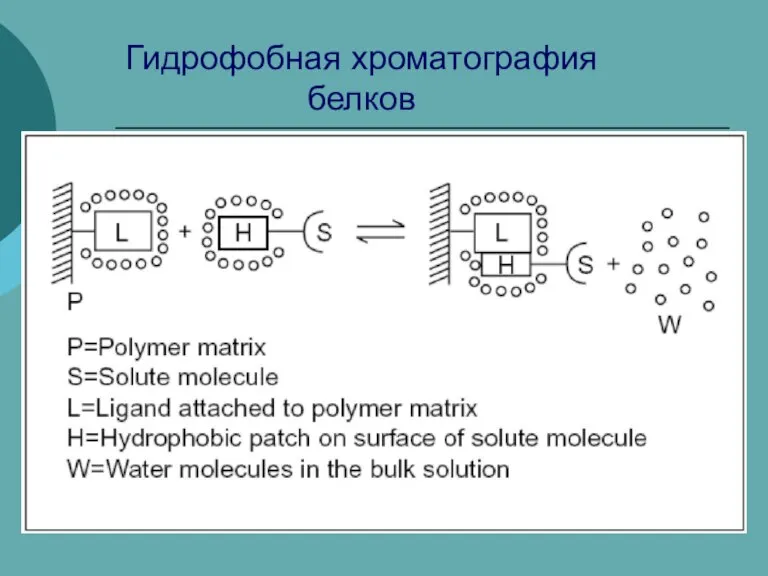 Гидрофобная хроматография белков
Гидрофобная хроматография белков агрегатные состояния вещества 7 класс
агрегатные состояния вещества 7 класс Классификация химических реакций по различным основаниям
Классификация химических реакций по различным основаниям Презентация на тему Полимеры
Презентация на тему Полимеры  АРЕНЫ
АРЕНЫ Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Углеводороды
Углеводороды Минерал гранат
Минерал гранат Классификация химических реакций
Классификация химических реакций Хімічна промисловість
Хімічна промисловість Неорганические основания
Неорганические основания