Содержание
- 2. Простые вещества состоят из атомов одного и того же элемента. Простые вещества-металлы при обычных условиях представляют
- 3. Оксиды Оксидами называют соединения, состоящие из двух элементов, одним из которых является кислород. ЭxOy – общая
- 4. Основные оксиды К основным оксидам относятся оксиды щелочных и щелочно-земельных металлов, а также многие оксиды других
- 5. Кислотные оксиды Кислотные оксиды образуют неметаллы (Cl2O, B2O3, CO2, N2O5, SO3, Cl2O7 и др.), а также
- 6. Амфотерные оксиды Амфотерные оксиды образуют металлы, имеющие степени окисления +3, +4, иногда +2. К амфотерным оксидам
- 7. Если элемент образует несколько оксидов, то по мере увеличения его степени окисления усиливается кислотный характер оксида.
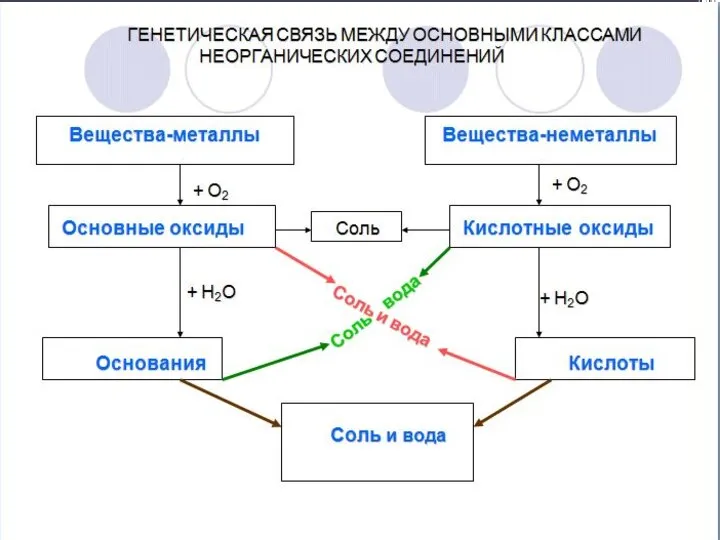
- 8. Большинство оксидов непосредственно соединяется с водой, в результате образуются гидраты оксидов (гидроксиды). Оксид + Вода =
- 9. Гидроксиды Гидроксиды бывают: 1) основные (основания); 2) кислотные (кислоты); 3) амфотерные (амфолиты). Основания Основания – это
- 10. Основания диссоциируют (распадаются) на ионы металла и гидроксильные ионы. Ва(ОН)2=Ва2+ + 2ОН- гидроксид бария КОН =
- 11. Растворимые в воде основания называются щелочами (это гидроксиды щелочных и щелочно-земельных металлов) они также называются сильными
- 12. Химические свойства оснований Основания образуют с кислотными оксидами соль и воду: Ba(OH)2 + CO2 = BaCO3
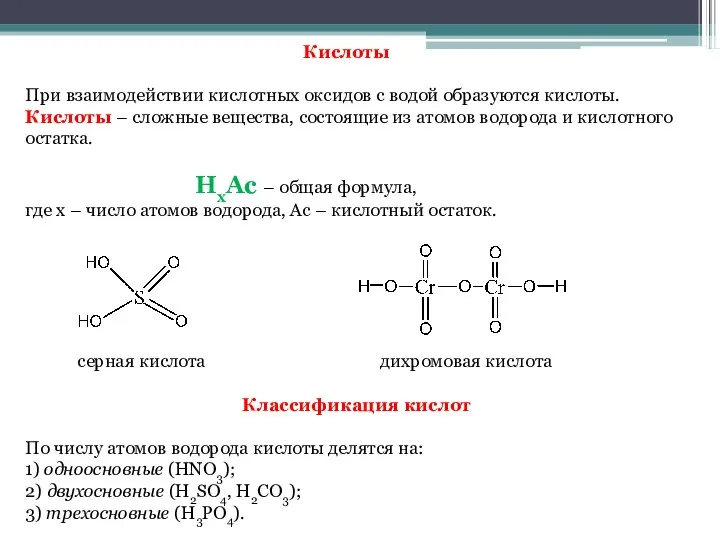
- 13. Кислоты При взаимодействии кислотных оксидов с водой образуются кислоты. Кислоты – сложные вещества, состоящие из атомов
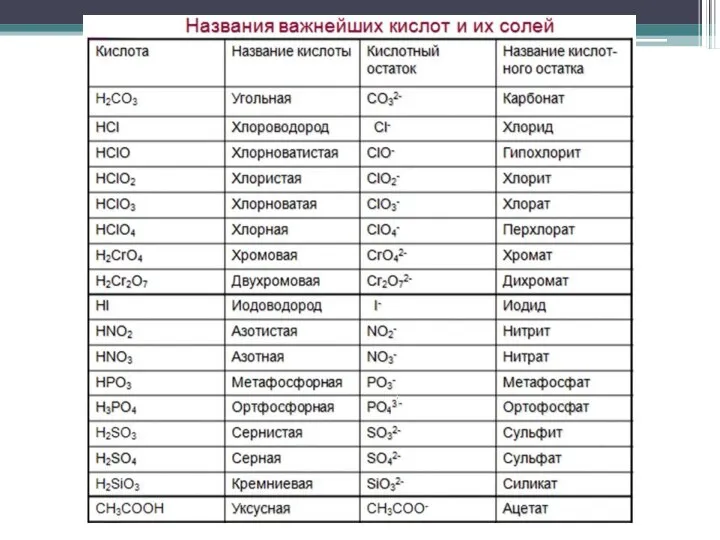
- 14. По содержанию кислорода кислоты бывают: бескислородные (HCl, HBr, HCN); кислородсодержащие (H2SO4, H2CO3 и т.д.). Кислоты диссоциируют
- 15. Растворы сильных кислот характеризуются высокой концентрацией ионов водорода, т.е. представляют собой сильнокислую среду. Растворы слабых кислот
- 17. Химические свойства кислот Кислоты взаимодействуют с основаниями - реакция нейтрализации. Нейтрализация – это взаимодействие между кислотой
- 18. Амфолиты Амфолиты – амфотерные гидроксиды – соединения, проявляющие свойства кислот и оснований в зависимости от среды
- 19. Соли Соли - это сложные вещества, состоящие из ионов металла и кислотного остатка. Соли бывают: средние
- 20. Химические свойства солей Соли взаимодействуют с кислотами и щёлочами: BaCl2 + H2SO4 = BaSO4↓ + 2
- 21. Получение солей Средние соли могут быть получены многими способами: 1) взаимодействием металла с неметаллом 2 Na
- 22. 6) взаимодействием соли с солью Pb(NO3)2 + Na2SO4 = PbSO4↓ + 2 NaNO3; 7) взаимодействием основного
- 23. Кислые соли могут быть получены в кислой среде: 1) взаимодействием основания с кислотой (избыток) NaOH +
- 26. Скачать презентацию




















 Исследование структуры продуктов аммонолиза мезопористых магниетермических порошков тантала
Исследование структуры продуктов аммонолиза мезопористых магниетермических порошков тантала Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений
Эффект растворителя при определении пространственной структуры сложных гетероциклических соединений Презентация по Химии "Токсическое действие неорганических веществ"
Презентация по Химии "Токсическое действие неорганических веществ"  Кислоты и их свойства
Кислоты и их свойства Vodík
Vodík Разбор домашнего задания
Разбор домашнего задания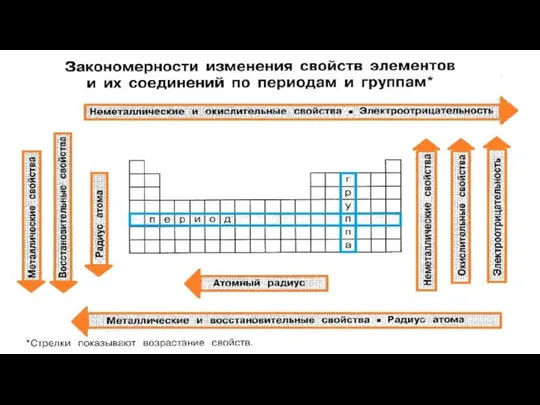 Закономерности изменения свойств элементов и их соединений по периодам и группам
Закономерности изменения свойств элементов и их соединений по периодам и группам 1_
1_ Определение степеней окисления и расстановка коэффициентов в ОВР
Определение степеней окисления и расстановка коэффициентов в ОВР Элементы, названные в честь исследователей
Элементы, названные в честь исследователей Углеводороды
Углеводороды Презентация на тему Карбоновые кислоты и их производные
Презентация на тему Карбоновые кислоты и их производные  Кремень. Нахождение в природе
Кремень. Нахождение в природе Презентация на тему Альдегиды
Презентация на тему Альдегиды  Изомерия. Виды изомерии
Изомерия. Виды изомерии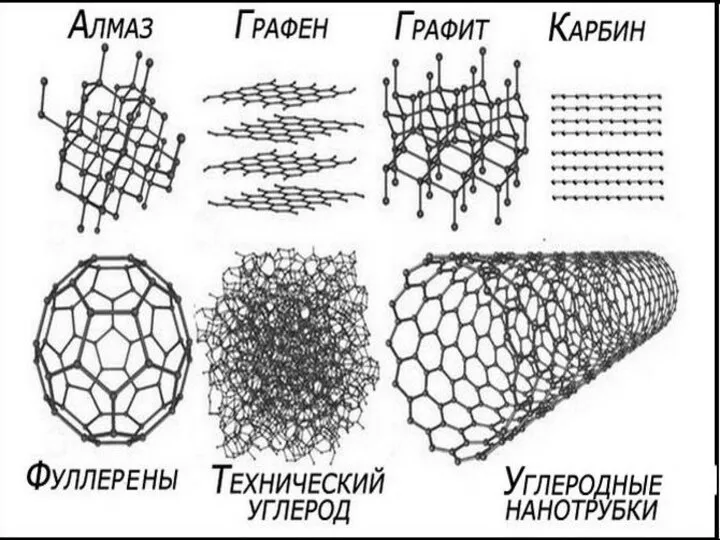 Углеродные нанотрубки
Углеродные нанотрубки Водород. Свойства, применение
Водород. Свойства, применение Природный газ
Природный газ Органические реагенты
Органические реагенты Презентация на тему Жесткость воды
Презентация на тему Жесткость воды  Алкины в жизни человека
Алкины в жизни человека Порядок констант ССВ JHH в бензоле. Задачи
Порядок констант ССВ JHH в бензоле. Задачи Как вырастить кристалл
Как вырастить кристалл Алканы. Этан
Алканы. Этан Практико-ориентированные задачи по химии для студентов гуманитарных специальностей
Практико-ориентированные задачи по химии для студентов гуманитарных специальностей Презентация на тему Растворение. Растворы (8 класс)
Презентация на тему Растворение. Растворы (8 класс)  Презентация на тему Актуальные проблемы газовой отрасли России
Презентация на тему Актуальные проблемы газовой отрасли России  Химический элемент титан
Химический элемент титан