Содержание
- 2. Литература Основная: Дополнительная:
- 4. Основные химические понятия и законы Атом – электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра (образованного
- 5. Относительной атомной массой элемента называют отношение абсолютной массы атома к 1/12 части абсолютной массы атома изотопа
- 6. Моль - это единица количества вещества (ν), содержащая столько структурных единиц данного вещества, сколько атомов содержится
- 7. Основные стехиометрические законы 1.Закон сохранения массы веществ (М. В. Ломоносов, 1748-1756гг.; Антуан-Лоран Лавуазье, французский химик, 1777
- 9. 3. Закон Авогадро (Амедео Авогадро, итальянский химик, 1811 г.) В равных объемах различных газов при одинаковых
- 10. ХИМИЧЕСКИЙ ЭКВИВАЛЕНТ 4. Закон эквивалентов (Иеремия Вениамин Рихтер, немецкий химик, 1792-1800 гг). Вещества реагируют друг с
- 11. В кислотно-основной реакции H2SO4 + 2NaOH = Na2SO4 + 2H2O эквивалентом серной кислоты является условная частица
- 12. ФАКТОР ЭКВИВАЛЕНТНОСТИ Фактор эквивалентности – это число, показывающее, какая доля реальной частицы эквивалентна одному катиону водорода
- 13. ФАКТОР ЭКВИВАЛЕНТНОСТИ В первой реакции H2SO4 + NaOH = NaHSO4 + H2O фактор эквивалентности серной кислоты
- 14. ФАКТОР ЭКВИВАЛЕНТНОСТИ Во второй реакции H2SO4 + 2NaOH = Na2SO4 + 2H2O фактор эквивалентности равен ?
- 15. ФАКТОР ЭКВИВАЛЕНТНОСТИ Итак: 1. Для кислот фактор эквивалентности равен 1, деленной на число катионов водорода Н+
- 16. 2. Для оснований фактор эквивалентности равен 1, деленной на число гидроксид-ионов основания ОН-, вступающих в реакцию
- 17. ФАКТОР ЭКВИВАЛЕНТНОСТИ 3. Для солей фактор эквивалентности равен 1, деленной на произведение числа катионов (анионов) и
- 18. МОЛЯРНАЯ МАССА ЭКВИВАЛЕНТА Молярная масса эквивалента (МЭ) – масса 1 моль эквивалентов. Она равна произведению фактора
- 20. Скачать презентацию

















 Цикл фосфора (окончание). Цикл в реках и в море
Цикл фосфора (окончание). Цикл в реках и в море Изучение фотокатализа в химии
Изучение фотокатализа в химии Кондуктометрический анализ
Кондуктометрический анализ Карбоновые кислоты
Карбоновые кислоты Теория электролитической диссоциации
Теория электролитической диссоциации Презентация на тему Общая характеристика галогенов
Презентация на тему Общая характеристика галогенов  Химические свойства металлов
Химические свойства металлов Мышьяк (As)
Мышьяк (As) Как искупаться дома в морской воде?
Как искупаться дома в морской воде? Практическая работа: Очистка загрязнённой поваренной соли
Практическая работа: Очистка загрязнённой поваренной соли Методы диагностики плазмы
Методы диагностики плазмы Алюминий. 9 класс
Алюминий. 9 класс Понятие о пестицидах. Меры безопасности при работе с ядами
Понятие о пестицидах. Меры безопасности при работе с ядами Знаки химических элементов
Знаки химических элементов Нуклеиновые кислоты
Нуклеиновые кислоты Осторожно, химия
Осторожно, химия Материаловедение. Методы исследования в материаловедении (лекция 1)
Материаловедение. Методы исследования в материаловедении (лекция 1) Неорганические вещества клетки. 10 класс
Неорганические вещества клетки. 10 класс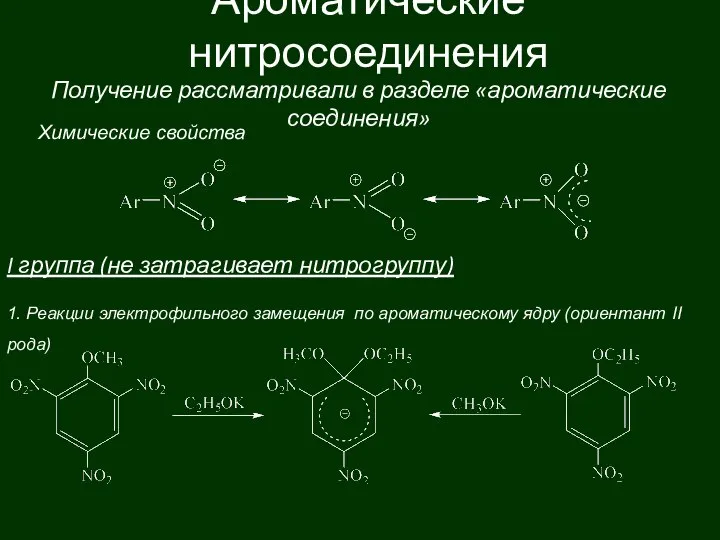 Ароматические нитросоединения
Ароматические нитросоединения Тренинг по решению задач разной степени сложности по теме Углеводороды
Тренинг по решению задач разной степени сложности по теме Углеводороды Электролиз
Электролиз Автомобильные бензины. Свойства топлив
Автомобильные бензины. Свойства топлив Виды твердых тел
Виды твердых тел Svins. Iegūšana
Svins. Iegūšana Решение задач на основные законы и понятия химии
Решение задач на основные законы и понятия химии Практико-ориентировочный проект Оксиды на службе у человека
Практико-ориентировочный проект Оксиды на службе у человека способы разделения смесей
способы разделения смесей Металлы и неметаллы
Металлы и неметаллы