Содержание
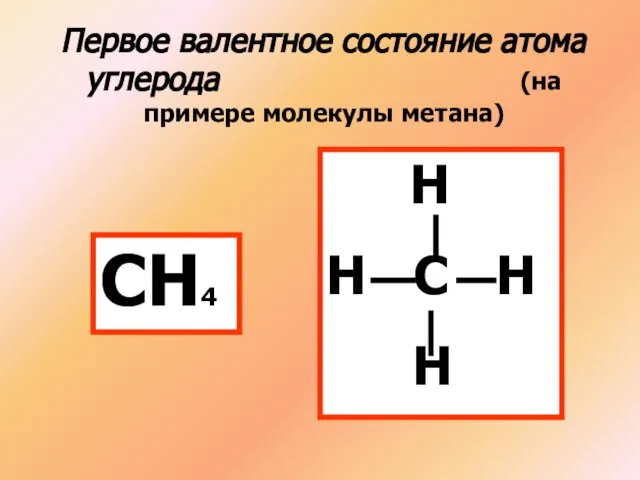
- 2. Первое валентное состояние атома углерода (на примере молекулы метана) СН4 Н Н С Н Н
- 3. Два «противоречия» в строении метана: Валентность углерода равна четырем в наличии только 2 валентных электрона Решение:
- 4. 2 противоречие: В молекуле все четыре связи одинаковые по теории – одна SS связь и три
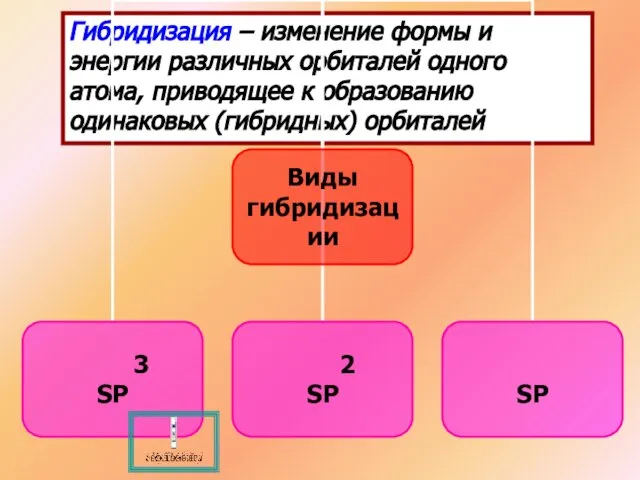
- 5. Гибридизация – изменение формы и энергии различных орбиталей одного атома, приводящее к образованию одинаковых (гибридных) орбиталей
- 6. Второе валентное состояние атома углерода (на примере молекулы этилена) С2Н4 СН2 СН2 Атомы углерода в молекуле
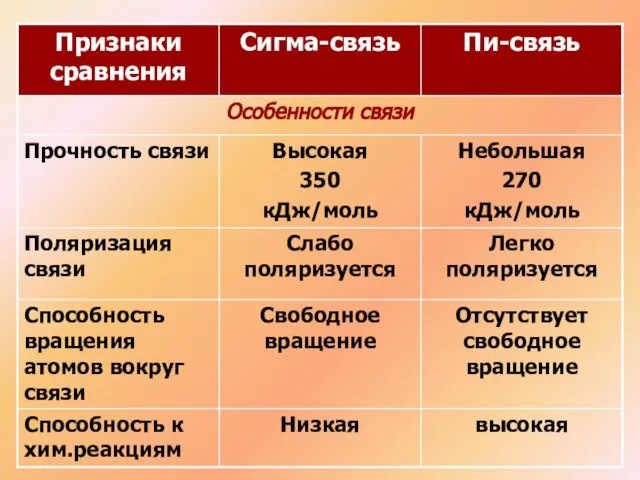
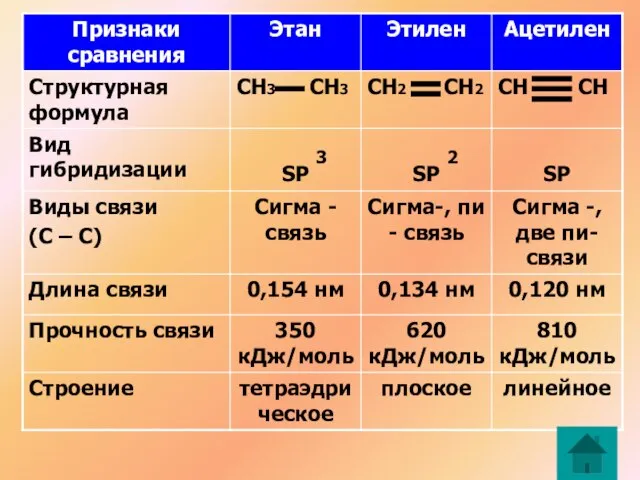
- 7. Связи в этилене неравноценны: (сигма) – более прочная (пи) – легче рвется, более реакционноспособна, плотность электронного
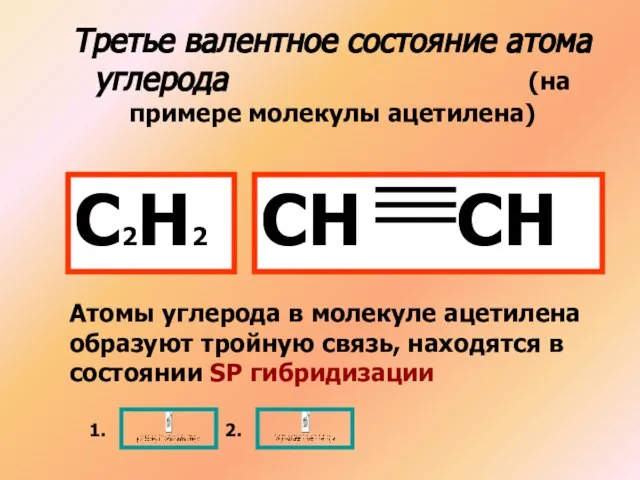
- 10. Третье валентное состояние атома углерода (на примере молекулы ацетилена) С2Н2 СН СН Атомы углерода в молекуле
- 11. 3 2
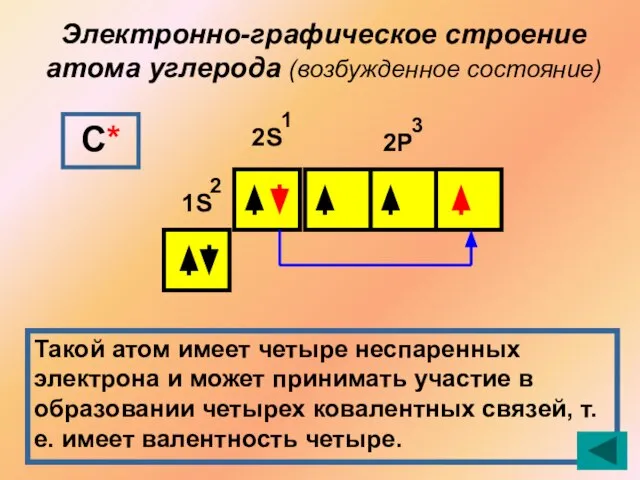
- 12. Электронно-графическое строение атома углерода (возбужденное состояние) 1S 2S 2Р 2 1 3 С* Такой атом имеет
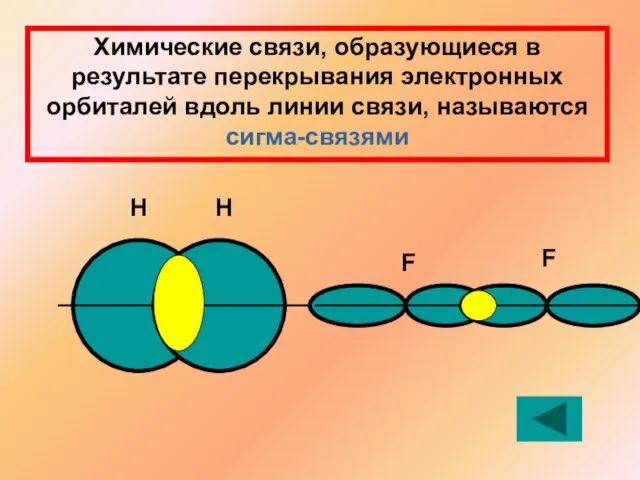
- 13. Химические связи, образующиеся в результате перекрывания электронных орбиталей вдоль линии связи, называются сигма-связями Н Н F
- 15. Скачать презентацию





 Предельные углеводороды насыщенные, парафины, алканы
Предельные углеводороды насыщенные, парафины, алканы Органическая химия- химия соединений углерода
Органическая химия- химия соединений углерода Презентация на тему Кремний и его соединения
Презентация на тему Кремний и его соединения  Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Алюминий и его соединения
Алюминий и его соединения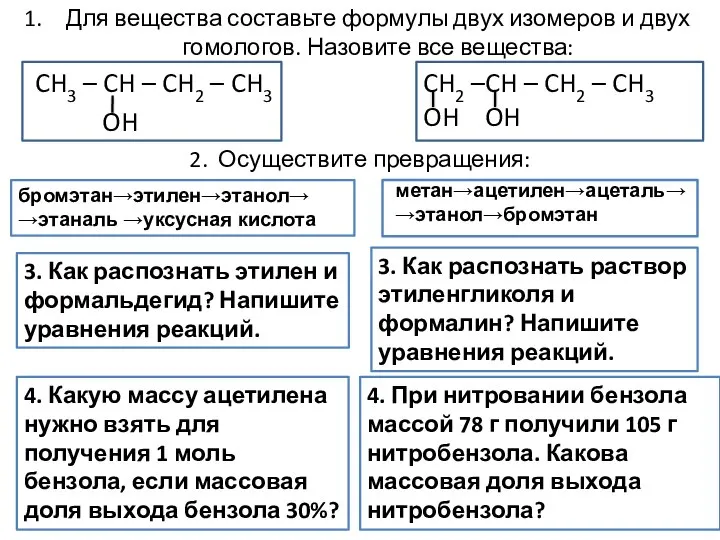 Формулы двух изомеров и двух гомологов
Формулы двух изомеров и двух гомологов Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Органическая химия. Ароматические углеводороды
Органическая химия. Ароматические углеводороды Химия. 8 класс. Подготовка к контрольной работе
Химия. 8 класс. Подготовка к контрольной работе Нанотехнологии в быту
Нанотехнологии в быту Аналитические методы в современных исследованиях химии
Аналитические методы в современных исследованиях химии Биохимия крови
Биохимия крови Элементы принадлежащие к VII группе периодической таблицы - галогены
Элементы принадлежащие к VII группе периодической таблицы - галогены Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса
Самостоятельные работы по разделу Химические реакции в рамках рабочей программы по химии для 8 класса Лекция № 1
Лекция № 1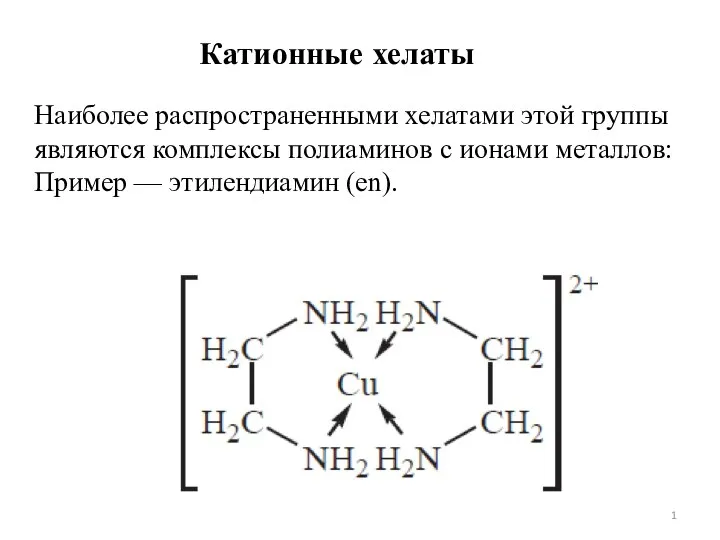 Хелатный эффект. Лекция 7
Хелатный эффект. Лекция 7 Классификация углеводородов
Классификация углеводородов Массовые доли веществ задачи
Массовые доли веществ задачи Классификация аминокислот в зависимости от природы радикалов
Классификация аминокислот в зависимости от природы радикалов Спирты. Общая формула, номенклатура
Спирты. Общая формула, номенклатура Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2 Презентация на тему Фосфорная кислота и ее свойства
Презентация на тему Фосфорная кислота и ее свойства  Вещество. Свойства веществ
Вещество. Свойства веществ Минералы
Минералы Относительная атомная масса
Относительная атомная масса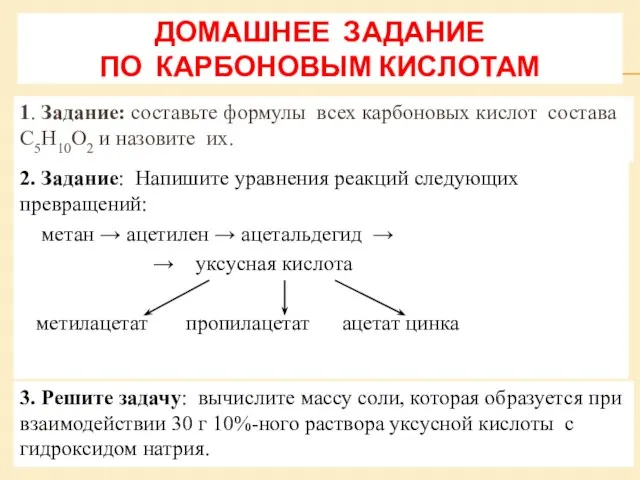 Карбоновые кислоты
Карбоновые кислоты