Слайд 2Цель работы
Рассмотреть работу ГЭ и объяснить
возникновение ГЭ при коррозии
контактных пар

металлов.
Слайд 3Теоретическое обоснование
Коррозия – самопроизвольный процесс
разрушения металла, вызываемого его
окислением.
Коррозия –

это взаимодействие металлов
с окружающей средой
Меt - nе- = Меtn+,
которое приводит к изменению свойств
материала. Процесс этот необратимый.
Слайд 4Электрохимическая коррозия
Большая часть коррозионных процессов
относится к электрохимическим, которые
протекают с участием

электрохимических
ячеек, подобных гальваническим
элементам и называемых коррозионными
элементами.
Слайд 5Электрохимическая коррозия
Механизм электрохимической коррозии,
определяемый разностью потенциалов
- пассивных (катод)
среда (окислитель)

+ nе- = продукты
- и активных (анод)
Меt - nе- = Меtn+
участков,
и сводится к работе гальванического
элемента.
Слайд 6Электрохимическая коррозия
Часто роль окислителя играет вода,
растворённый в воде кислород или, в

некоторых случаях, ионы водорода Н+
2 Н2О + 2 ē = Н2 + 2 -ОН,
О2+ 2 Н2О + 4 ē = 4 -ОН ,
2Н+ + 2 ē = Н2↑.
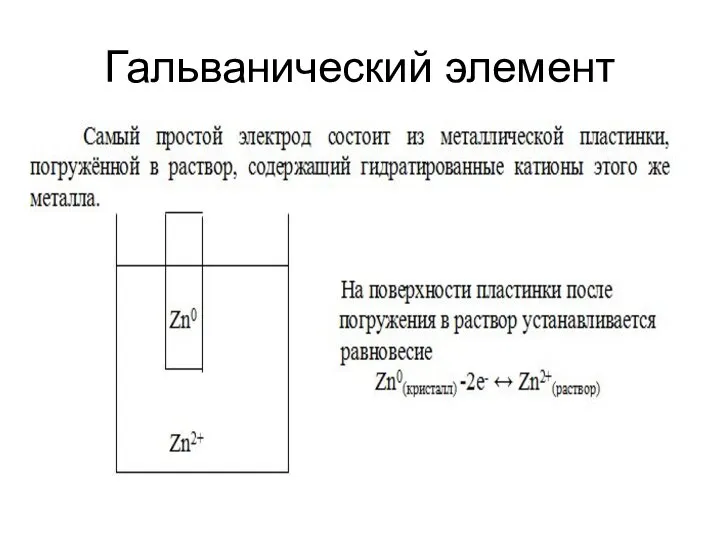
Слайд 8Гальванический элемент
В результате процесса окисления (прямой процесс) на пластинке появляется отрицательный

заряд, который увеличивается и к моменту равновесия становится величиной постоянной, выраженной как электрический потенциал (φ).
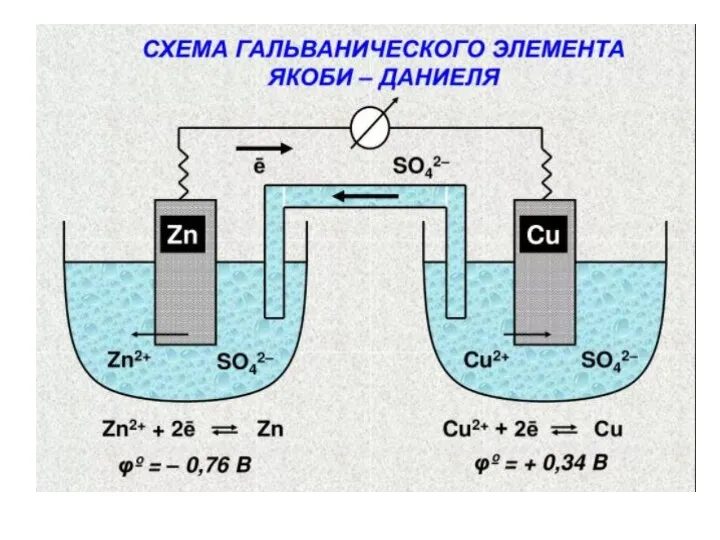
Слайд 9Гальванический элемент
ОВР может служить источником электрической энергии,
если она протекает в соответствующем

приборе –
гальваническом элементе, в котором реакция
окисления физически отделена от реакции
восстановления, а перенос электронов осуществляется
по внешней электрической цепи. Для того, чтобы цепь
была замкнута, используют «солевой мостик» -
внутренняя цепь, по которой осуществляется ионная
проводимость.
Гальванические элементы обычно обозначают
так
Zn0/Zn2+ // Сu2+/Сu0
Слайд 11Гальванический элемент
При работе гальванических элементов система с более высоким значением электродного

потенциала выступает в качестве окислителя (катод), а с более низким – восстановителя (анод).
Слайд 12Ход работы
Опыт 1. Гальванический элемент
Составляем схему ГЭ, записываем
уравнения электродных реакций и

общее
уравнение процесса.
Записываем вывод.
Слайд 13Опыт 2.
Возникновение ГЭ при контакте
металлов, находящихся в кислой среде.
https://yadi.sk/i/DQ1SoUYFvWx56w
Приготовить разбавленный

раствор серной кислоты.
Внести в пробирку с раствором цинковую гранулу.
Дождаться момента, когда гранула покроется
пузырьками газа. Внести в пробирку медную проволоку
и прикоснуться проволокой к поверхности гранулы
цинка. Отметить наблюдения.
Слайд 14Опыт 2.
Записать уравнения электродных
реакций. И общее уравнение реакции.
Составить схему гальванического

элемента.
Слайд 15Опыт 3
Электрохимическая коррозия.
https://yadi.sk/i/el52ujUWsL5dUQ
В разбавленные растворы серной
кислоты объёмом 2-3 мл добавить 1-2

раствора гексационоферрата (III) калия и
в каждую внести контактную пару
металлов Fe/Cu и Fe/Zn. Отметить
наблюдения. Сделать выводы.
Слайд 16Опыт 3
Записать уравнения электродных
процессов и общие уравнения реакций.
Составить схемы гальванических

элементов.













 Диссоциация кислот
Диссоциация кислот Составление формул оксидов, оснований, солей
Составление формул оксидов, оснований, солей Кислотно-основные взаимодействия
Кислотно-основные взаимодействия Железо и его соединения. Строение атома железа
Железо и его соединения. Строение атома железа Презентация на тему Твердые вещества
Презентация на тему Твердые вещества  Жиры. Классификация жиров
Жиры. Классификация жиров Неорганические вещества клетки
Неорганические вещества клетки Эмульсии как лиофобные дисперсные системы
Эмульсии как лиофобные дисперсные системы Алюминий
Алюминий Презентация на тему Кислород О2
Презентация на тему Кислород О2  Кислородсодержащие органические вещества
Кислородсодержащие органические вещества Значение воды на Земле
Значение воды на Земле Структура периодической таблицы элементов
Структура периодической таблицы элементов Увлекательный мир науки и практики
Увлекательный мир науки и практики Строение органических молекул. (Лекция 2)
Строение органических молекул. (Лекция 2) Соединения алифатического ряда
Соединения алифатического ряда Свойства воды
Свойства воды Сложные вещества кислоты
Сложные вещества кислоты Отчет по ПП.03.01 Лаборант химического анализа
Отчет по ПП.03.01 Лаборант химического анализа 10_kl_klas-ya
10_kl_klas-ya Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Защита металлов от коррозии
Защита металлов от коррозии Лаки. Эмали. Красочные составы
Лаки. Эмали. Красочные составы Определение химического эквивалента, эквивалентной и атомной массы металла
Определение химического эквивалента, эквивалентной и атомной массы металла Контрольна робота, хімія
Контрольна робота, хімія Растворы. Типы растворов. Способы выражения концентрации растворов
Растворы. Типы растворов. Способы выражения концентрации растворов Составление ионных уравнений
Составление ионных уравнений Химическая термодинамика
Химическая термодинамика