Содержание
- 2. Классификация реакций Неокислительно-восстановительные реакции Ag +1Cl -1+Na +12S -2 = Ag +12S -2+Na +1Cl-1 Окислительно-восстановительные реакции
- 3. Окислительно-восстановительные реакции – реакции, протекающие с изменением степеней окисления атомов всех или некоторых элементов, входящих в
- 4. Окисление и восстановление Процесс отдачи электронов атомов, молекулой или ионом называют окислением. H 02 +O 02=H
- 5. Процесс присоединения электронов атомом, ионом или молекулой называют восстановлением. H 02 +O 02=H +12O-2 2О0 +4е-
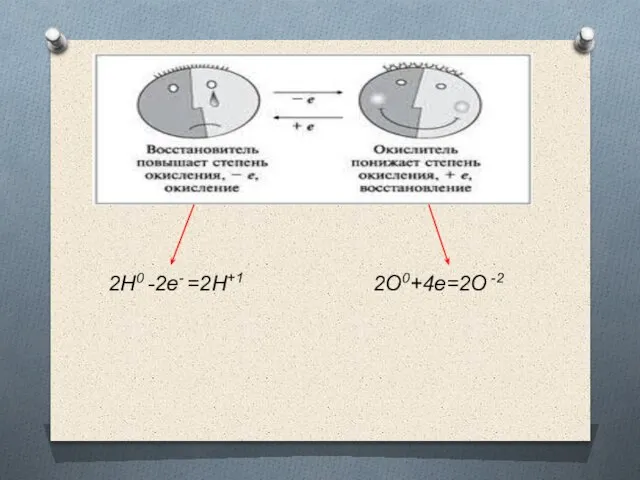
- 6. 2Н0 -2е- =2Н+1 2О0+4е=2О -2
- 7. Различают: минимальную (низшую) степень окисления S-2 2e- 8e- 8e- промежуточную степень окисления S0 2e- 8e- 6e-
- 8. Восстановители Простые вещества металлы могут быть только восстановителями. В периодах с возрастанием атомного номера восстановительные свойства
- 9. Окислители Простые вещества являющиеся только окислителями – это фтор и кислород (кроме реакции со фтором). В
- 10. Окислительно-восстановительная двойственность Вещества, содержащие в составе атомы элементов в промежуточной степени окисления, способны проявлять как окислительные,
- 11. Составление уравнений ОВР Для cocтaвлeния урaвнeний oкиcлитeльнo-вoccтaнoвитeльныx рeaкций нaибoлee чaстo испoльзуют метод электронного баланса и метод
- 12. 1. Запишем формулы исхoдных вeщecтв и прoдуктoв рeaкции: FeCl3 + H2S → FeCl2 + S +
- 13. 3. Cocтавим электронные урaвнeния, вырaжaющиe прoцeccы oкиcлeния и вoccтанoвлeния. По измeнeнию степеней окисления oпрeдeлим чиcлo электронов,
- 14. 5. Подберем стехиометрические коэффициенты ocтaльныxучacтникoв рeaкции, пeрeйдeм oт сxeмы к уравнению реакции (ставим знак равенства вместо
- 16. Скачать презентацию












 ЛКМ на основе кремнийорганических соединений
ЛКМ на основе кремнийорганических соединений Взаимодействие частиц конденсированной фазы, их срастание (коалесценция). Лекция 3
Взаимодействие частиц конденсированной фазы, их срастание (коалесценция). Лекция 3 Виды твердых тел
Виды твердых тел Значимые личности в химии
Значимые личности в химии Nazwa peptydu. Sekwencja
Nazwa peptydu. Sekwencja Перициклические реакции
Перициклические реакции Алкины
Алкины Щелочные металлы
Щелочные металлы Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Неметаллы
Неметаллы Железо в нашей жизни
Железо в нашей жизни Химические методы. Золь-гель метод
Химические методы. Золь-гель метод Основной государственный экзамен Химия 2021
Основной государственный экзамен Химия 2021 Pастворы, используемые в промышленности
Pастворы, используемые в промышленности Алкены. Химические и физические свойства
Алкены. Химические и физические свойства Карбоновые кислоты
Карбоновые кислоты Биоорганическая химия
Биоорганическая химия Строение атома
Строение атома Классификация химических реакций. 11 класс
Классификация химических реакций. 11 класс Силикатная промышленность
Силикатная промышленность Оксиды
Оксиды Структура и свойства чистого титана
Структура и свойства чистого титана Спирт – это жизненная необходимость или страшное зло…
Спирт – это жизненная необходимость или страшное зло… Белки
Белки Презентация по Химии "Металлы в организме человека"
Презентация по Химии "Металлы в организме человека"  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Полиморфизм. Аморфные вещества
Полиморфизм. Аморфные вещества 4 Минеральные удобрения (1)
4 Минеральные удобрения (1)