Карбонат кальция – СаСО 3 (Аналогично РbCO3). Запишем уравнение диссоциации данного соединения с учетом его растворимости (Х) и с учетом того, что из одного (г-моль /л) СаСО 3 получается один (г-ион/л) Са2+ и один (г-ион/л) СО32-:
Х (г-моль /л) Х (г-ион/л) Х (г-ион/л)
СаСО 3 = Са2+ + СО32- ПР СаСО 3 = Х2
2. Гидроксид магния – Mg(OH)2 :
Mg(OH)2 = Mg2+ + 2 ОН- ПР Mg(OH)2 = Х х( 2Х )2 = 4 Х3
3 . Гидроксид железа (3) – Fe(OH)3
Fe(OH)3 = Fe3+ + 3 OH- ПР Fe (OH)3 = Х х (3Х)3 = 27 Х4
4. Фосфат кальция - Са3(РО4)2
Са3(РО4)2 = 3 Са2+ + 2 РО43- ПР = (3Х)3х (2Х)2 = 108 Х5







 Роль железа в жизни общества и в здоровье человека
Роль железа в жизни общества и в здоровье человека Типы химических реакций. 8 класс
Типы химических реакций. 8 класс Сера. Физические и химические свойства. Нахождение в природе
Сера. Физические и химические свойства. Нахождение в природе Электролитическая диссоциация
Электролитическая диссоциация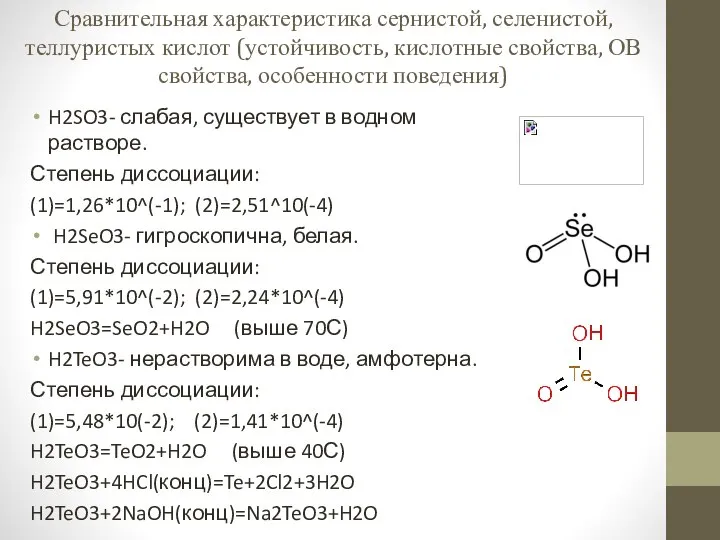 Сравнительная характеристика сернистой, селенистой, теллуристых кислот
Сравнительная характеристика сернистой, селенистой, теллуристых кислот Неорганические вещества клетки для дистанта (2)
Неорганические вещества клетки для дистанта (2) Увлекательный мир химии
Увлекательный мир химии Опыт Пилатра де Розьера
Опыт Пилатра де Розьера Презентация на тему Интерактивная игра "Химический лабиринт"
Презентация на тему Интерактивная игра "Химический лабиринт"  Магматические горные породы
Магматические горные породы Натуральные и синтетические каучуки
Натуральные и синтетические каучуки Диаграмма состояния системы железо - углерод
Диаграмма состояния системы железо - углерод Алгоритм названия органического соединения
Алгоритм названия органического соединения Контрольная работа №1
Контрольная работа №1 Презентация на тему Химия и сельское хозяйство (11 класс)
Презентация на тему Химия и сельское хозяйство (11 класс)  Итоговая консультация. Формульный диктант
Итоговая консультация. Формульный диктант Сложные эфиры и жиры
Сложные эфиры и жиры Соли
Соли Спирты. Строение
Спирты. Строение Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот
Генетическая связь углеводородов, спиртов, альдегидов и карбоновых кислот Горные породы
Горные породы Презентация на тему Подгруппа углерода и азота
Презентация на тему Подгруппа углерода и азота  Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Висмут Bi
Висмут Bi Белки-1 2020
Белки-1 2020 Электролитическая диссоциация
Электролитическая диссоциация Химический состав клетки. Неорганические вещества
Химический состав клетки. Неорганические вещества Презентация на тему Сложные эфиры
Презентация на тему Сложные эфиры