Содержание
- 2. Podstawowe informacje z układu okresowego Symbol- Al. (łac. aluminium) Liczba atomowa jest równa 13 Grupa -
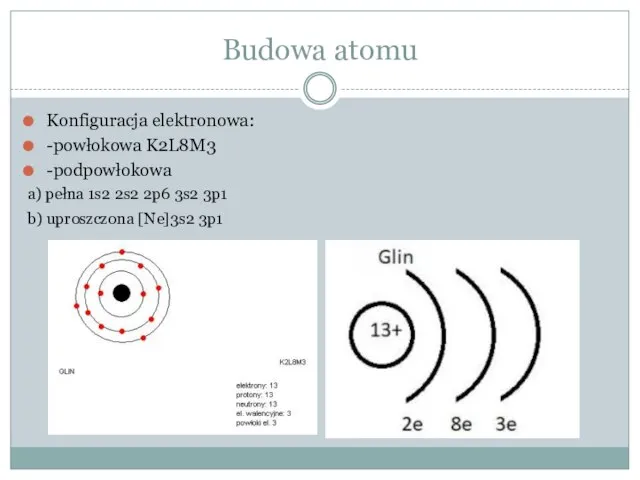
- 3. Budowa atomu Konfiguracja elektronowa: -powłokowa K2L8M3 -podpowłokowa a) pełna 1s2 2s2 2p6 3s2 3p1 b) uproszczona
- 4. Występowanie w skorupie ziemskiej Wartościowość- III Stopień utlenienia III Glin jest jednym z najbardziej rozpowszechnionym metalem
- 5. Ogólne właściwości glinu Glin jest to srebrzystobiały metal, o niebieskawym odcieniu, kowalny i ciągliwy. Jego stan
- 6. Zastosowanie Czysty glin wykorzystywany jest do wyrobu licznych przedmiotów codziennego użytku (np. naczynia kuchenne, lustra), do
- 7. Reakcje glinu W temp. 100oC glin reaguje z wodą wypierając z niej wodór i tworząc wodorotlenek
- 8. Reakcje Glinu Stężony kwas siarkowy i rozcieńczony kwas azotowy na gorąco rozpuszczają glin, jednak reakcja nie
- 9. Tlenek glinu i wodorotlenek glinu reakcje
- 10. Reakacje glinu z niemetalami w reakcji glinu z chlorem lub chlorowodorem: 2Al + 3Cl2 → 2AlCl3
- 12. Скачать презентацию
Слайд 2Podstawowe informacje z układu okresowego
Symbol- Al. (łac. aluminium)
Liczba atomowa jest równa 13
Grupa
Podstawowe informacje z układu okresowego
Symbol- Al. (łac. aluminium)
Liczba atomowa jest równa 13
Grupa

Okres- 3
Blok konfiguracyjny- p
Masa atomowa- 26,98154
Wartościowość- III
Stoi za magnezem i przed krzemem
Temperatura topnienia [oC]- 660,2
Temperatura wrzenia [oC]- 2447
Слайд 3Budowa atomu
Konfiguracja elektronowa:
-powłokowa K2L8M3
-podpowłokowa
a) pełna 1s2 2s2 2p6 3s2 3p1
b) uproszczona [Ne]3s2
Budowa atomu
Konfiguracja elektronowa:
-powłokowa K2L8M3
-podpowłokowa
a) pełna 1s2 2s2 2p6 3s2 3p1
b) uproszczona [Ne]3s2
Слайд 4Występowanie w skorupie ziemskiej
Wartościowość- III
Stopień utlenienia III
Glin jest jednym z najbardziej rozpowszechnionym metalem
Występowanie w skorupie ziemskiej
Wartościowość- III
Stopień utlenienia III
Glin jest jednym z najbardziej rozpowszechnionym metalem

Do najczęściej spotykanych glinokrzemianów zalicza się: skalenie, albit, anortyt, miki. Występuje również w gnejsie, granicie, porfirze, bazalcie i innych skałach magmowych. Czysty Al2O3 występuje jako korund, a zabarwiony domieszką innych metali jest kamieniem szlachetnym (czerwonym rubinem, niebieskim szafirem). Tlenek glinu występuje również w postaci uwodnionej jako jednoskośny hydrargilit, rombowy diaspor oraz rombowy bemit, stanowiący składnik aluminium (boksytu). Technicznie ważnymi surowcami do produkcji glinu są: boksyt i kriolit.
Слайд 5Ogólne właściwości glinu
Glin jest to srebrzystobiały metal, o niebieskawym odcieniu, kowalny i
Ogólne właściwości glinu
Glin jest to srebrzystobiały metal, o niebieskawym odcieniu, kowalny i

Glin jest pierwiastkiem trójwartościowym, występującym na stopniu utlenienia +3 (bardzo rzadko na +1 i +2). Spośród glinowców (glin, tal, ind, gal) wykazuje najwyższą elektroujemność i największą aktywność chemiczną. Na powietrzu pokrywa się cienką, lecz szczelną i niewidoczną dla oka warstewką ochronną tlenku glinu, która zapobiega dalszemu utlenianiu. W temp. 100oC glin reaguje z wodą wypierając z niej wodór i tworząc wodorotlenek glinu
Pasywacja jest procesem tworzenia się na powierzchni metalu ochronnej powłoki z jego tlenku powstałego na skutek reakcji metalu z np. tlenem z powietrza lub stężonym kwasem azotowym(V). Zabezpiecza to metal przed dalszą korozją i pozwala mu zachować jego właściwości. Ma to duże zastosowanie praktyczne, gdyż dzięki temu glin używany jest jako materiał do produkcji m.in. cystern do transportu stężonego kwasu azotowego(V).
Слайд 6Zastosowanie
Czysty glin wykorzystywany jest do wyrobu licznych przedmiotów codziennego użytku (np. naczynia
Zastosowanie
Czysty glin wykorzystywany jest do wyrobu licznych przedmiotów codziennego użytku (np. naczynia

Слайд 7Reakcje glinu
W temp. 100oC glin reaguje z wodą wypierając z niej wodór
Reakcje glinu
W temp. 100oC glin reaguje z wodą wypierając z niej wodór

Lub też w wyniku wprowadzenia dwutlenku węgla do roztworu glinianu:
2[Al(OH)4]- +CO2-> 2Al(OH)3+ CO3 2- + H2O
Rozpuszcza się w roztworach mocnych kwasów i mocnych zasad wydzielając wodór oraz tworząc w pierwszym przypadku sól glinową, a w drugim glinian:
2Al+6HCl→2AlCl3+3H2↑2Al+6HCl→2AlCl3+3H2↑ 2Al+2NaOH+6H2O→2Na[Al(OH)4]+3H2↑
*W drugim równaniu nie miałem jak zrobić indeksu górnego
Слайд 8Reakcje Glinu
Stężony kwas siarkowy i rozcieńczony kwas azotowy na gorąco rozpuszczają glin,
Reakcje Glinu
Stężony kwas siarkowy i rozcieńczony kwas azotowy na gorąco rozpuszczają glin,

2Al+6H2SO4→Al2(SO4)3+3SO2↑+6H2O2Al+6H2SO4→Al2(SO4)3+3SO2↑+6H2O oraz 8Al+27HNO3→8Al(NO3)3+3NH3+9H2O8Al+27HNO3→8Al(NO3)3+3NH3+9H2O.
Stężony kwas azotowy powoduje pasywację glinu.Glin łączy się nie tylko z wolnym tlenem, ale również z tlenem zawartym w tlenkach wielu innych metali np.
3Fe3O4+4Al→4Al2O3+9Fe
Glin w temperaturze pokojowej nie reaguje z tlenem, dopiero ogrzany do wysokiej temperatury spala się, tworząc tlenek glinu:
4Al+ 3O2?2Al2O3
Z rozcieńczonym kwasem azotowym(V) tworzy:
Al.+ 4HNO3?Al(NO3)3+NO+2H2O
Слайд 9Tlenek glinu i wodorotlenek glinu reakcje
Tlenek glinu i wodorotlenek glinu reakcje

Слайд 10Reakacje glinu z niemetalami
w reakcji glinu z chlorem lub chlorowodorem:
2Al + 3Cl2 → 2AlCl3 (podstawowa metoda przemysłowa)
2Al
Reakacje glinu z niemetalami
w reakcji glinu z chlorem lub chlorowodorem:
2Al + 3Cl2 → 2AlCl3 (podstawowa metoda przemysłowa)
2Al

W reakcji glinu z siarką: 2Al + 3S ---> Al2S3 (siarczek glinu)
2Al(OH)3 + 3H2SO4 + 12H2O ⇌ Al2(SO4)3·18H2O (Działanie kwasu siarkowego na wodorotlenek glinu, boksyty i inne związki glinu)
 Знаки химических элементов. Периодическая система
Знаки химических элементов. Периодическая система Абсолютное первенство по химии - 2012
Абсолютное первенство по химии - 2012 Алкены (непредельные углеводороды)
Алкены (непредельные углеводороды) Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами
Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами Циклоалканы
Циклоалканы Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты
Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории
Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Как искупаться дома в морской воде?
Как искупаться дома в морской воде? Открытия в химии
Открытия в химии Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена
Ключевые реакции и регуляторные ферменты начальных этапов углеводного обмена Карбонильные соединения – альдегиды
Карбонильные соединения – альдегиды Калифорний Cf
Калифорний Cf Действие активированного угля
Действие активированного угля Оксид кремния
Оксид кремния Ковалентная полярная связь
Ковалентная полярная связь Характеристика кислорода и серы
Характеристика кислорода и серы Химическая связь. Ковалентная связь
Химическая связь. Ковалентная связь Ароматические гетероциклические соединения
Ароматические гетероциклические соединения Учебник системы учебно-методических комплектов Алгоритм успеха
Учебник системы учебно-методических комплектов Алгоритм успеха Металлургия
Металлургия Азот N2
Азот N2 Качественная реакция на многоатомные спирты
Качественная реакция на многоатомные спирты Презентация на тему Катализ
Презентация на тему Катализ  Жиры. Открытие жиров
Жиры. Открытие жиров Каучук. Строение и применение
Каучук. Строение и применение каталитический крекинг
каталитический крекинг