Содержание
- 3. Из 109 химических элементов 22 неметаллы, расположены в правом верхнем углу ПСХЭ. Неметаллы характеризуются маленькими радиусами
- 4. Химическая связь –ковалентная неполярная Ковалентная неполярная связь - осуществляется посредством образования общих электронных пар между атомами
- 5. Инертные или благородные газы не образуют молекул и существуют в атомарном состоянии Многие неметаллы образуют молекулу,
- 6. При обычной температуре неметаллы могут быть в разном агрегатном состоянии жидкие - Br -бром твердые –
- 7. Многие не проводят электрический ток (кроме графита и кремния). Не проводят тепло. В твердом состоянии- хрупкие
- 8. Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества –
- 9. 1. строение молекулы пример: О2 и О3 2.строение кристаллической решетки пример: алмаз и графит Причины аллотропии
- 10. Аллотропные формы кислорода Кислород образует две аллотропные модификации (причина- строение молекулы) Кислород O2 Газ без цвета
- 11. Аллотропные модификации углерода Углерод образует две аллотропные формы (причина – строение кристаллической решётки) Алмаз Тетраэдрическая крист.
- 12. Аллотропные модификации фосфора Фосфор образует семь аллотропных модификаций, причиной является строение кристаллической решётки. Наиболее известны две
- 13. Есть ли аллотропия у металлов? Надо отметить, что аллотропные формы образуют не только неметаллы, но и
- 14. Химические свойства неметаллов Проявляют сильные окислительные свойства, но многие могут выступать и как восстановители ( исключение
- 15. Совершите преобразования S SO3 H2SO4 CaSO4
- 16. Воздух - смесь неметаллов и их соединений. В конце ХYlll века А.Л.Лавуазье установил, что воздух не
- 17. Состав воздуха Постоянная составная часть воздуха: по объёму по массе Азот N2 78,2% 75,50% Кислород O2
- 18. Переменные составные части воздуха - это CO2 , H2O и О3 Случайные составные части воздуха –
- 19. Воздух, свободный от переменных и случайных составных частей, прозрачен, лишён цвета, вкуса и запаха, Мвоздуха= 29г/см3
- 21. Скачать презентацию


















 Своя игра. Атомы
Своя игра. Атомы Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Бирюза. Характеристики минерала
Бирюза. Характеристики минерала Методы разделения и очистки веществ
Методы разделения и очистки веществ Окисники, відновники
Окисники, відновники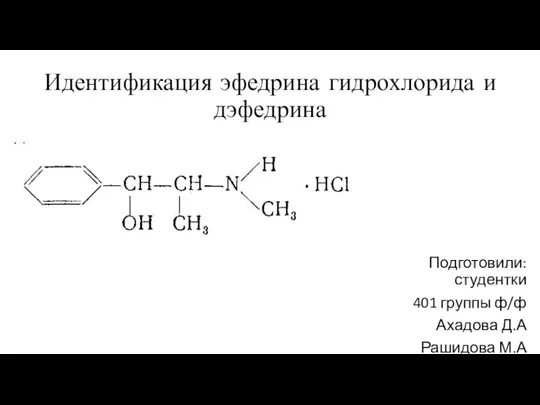 Идентификация эфедрина гидрохлорида и дэфедрина
Идентификация эфедрина гидрохлорида и дэфедрина Презентация на тему Великие химики
Презентация на тему Великие химики  Вывод и обсуждение
Вывод и обсуждение Спирты. Тест
Спирты. Тест Химические реакции. Классификация
Химические реакции. Классификация Классы неорганических соединений
Классы неорганических соединений Презентация на тему Фосфорная кислота и ее свойства
Презентация на тему Фосфорная кислота и ее свойства  Кристаллическая структура вещества. Характеристика вещества по формуле
Кристаллическая структура вещества. Характеристика вещества по формуле Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д. И. Менделеева Сера и его соединения
Сера и его соединения Диссоциация кислот
Диссоциация кислот Основания, их состав и название
Основания, их состав и название Периодическая система
Периодическая система Ароматические углеводороды
Ароматические углеводороды Сплавы на основе меди, титана, никеля
Сплавы на основе меди, титана, никеля Технология синтеза КТ CdSe
Технология синтеза КТ CdSe Гидролиз солей
Гидролиз солей Презентация на тему Азотная кислота (9 класс)
Презентация на тему Азотная кислота (9 класс)  Гидроксиды металлов
Гидроксиды металлов Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас
Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас Химическая технология органических веществ
Химическая технология органических веществ Генетическая связь веществ. Виды реакций
Генетическая связь веществ. Виды реакций Понятие о полимере. Технологии обработки пластмасс
Понятие о полимере. Технологии обработки пластмасс