Содержание
- 2. Какие из химических реакций являются обратимыми? 1. NaOH + HCl ? NaCl + H2O 2. N2
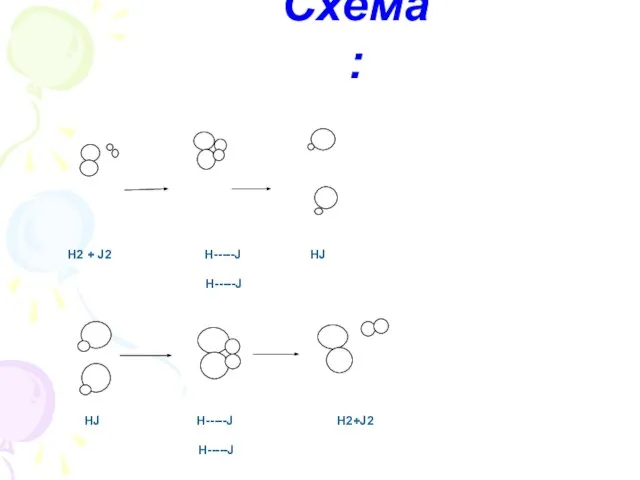
- 3. Схема: Н2 + J2 Н-----J HJ Н-----J HJ Н-----J H2+J2 Н-----J
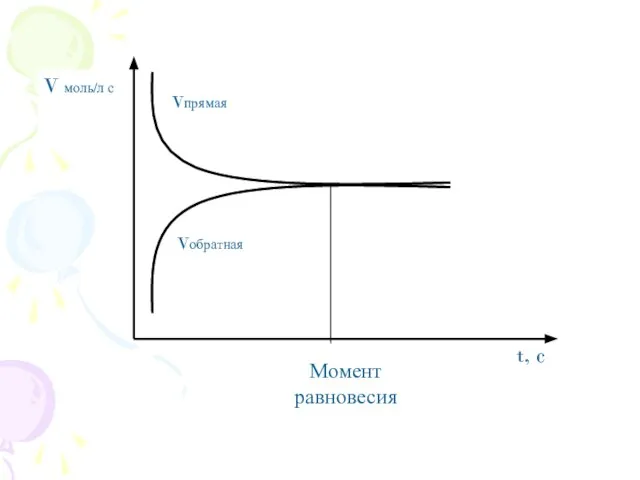
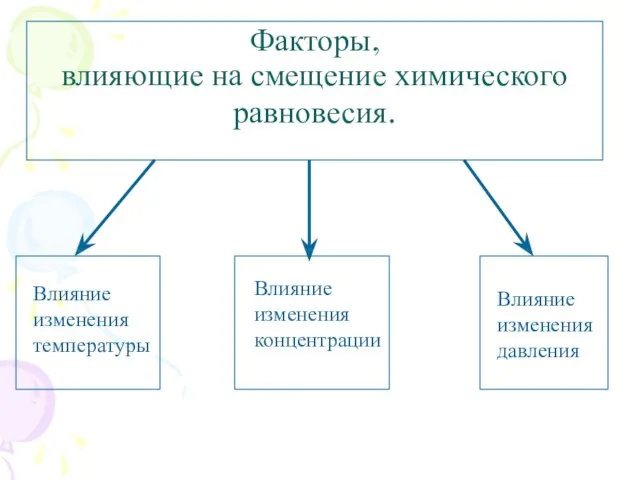
- 5. Факторы, влияющие на смещение химического равновесия.
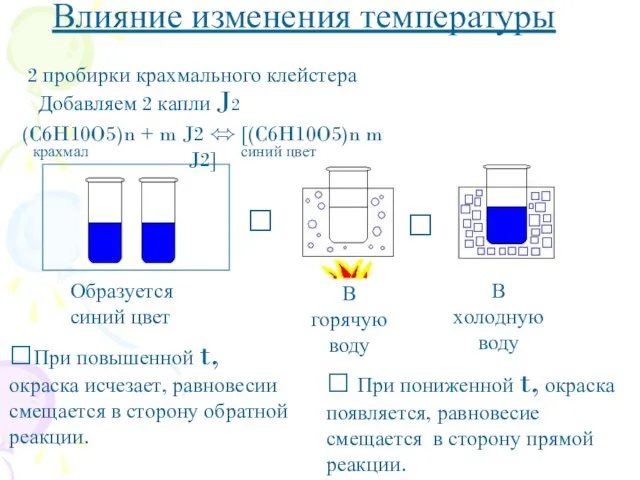
- 6. ? ? Влияние изменения температуры 2 пробирки крахмального клейстера Добавляем 2 капли J2 ?При повышенной t,
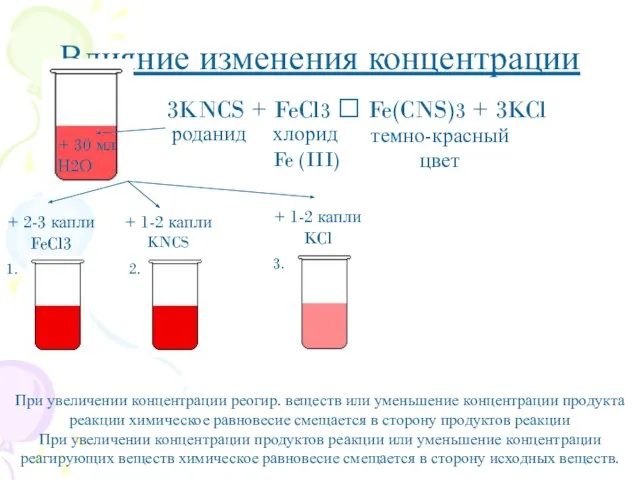
- 7. Влияние изменения концентрации + 2-3 капли FeCl3 + 1-2 капли KNCS + 1-2 капли KCl При
- 8. Влияние изменения давления 2NO2 ⬄ N2O4 + Q При расширении цвет газа стал темно-бурым, а равновесие
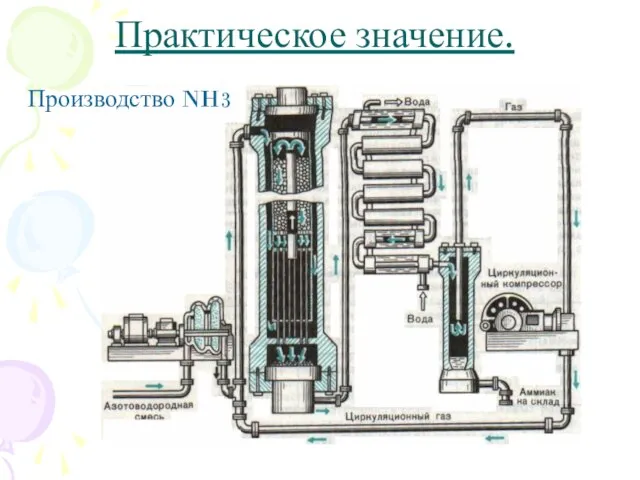
- 9. Практическое значение. Производство NH3
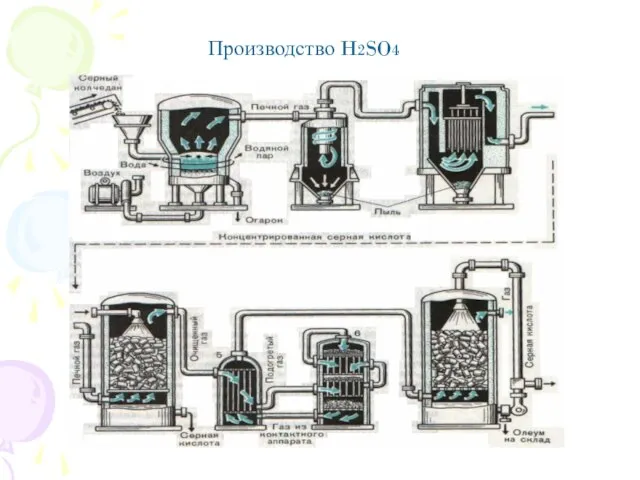
- 10. Производство H2SO4
- 11. Производство HNO3
- 12. 1.Смещение химического равновесия обеспечивает высокий выход желаемого продукта. 2. Открывает путь к управлению химическими реакциями.
- 14. Скачать презентацию




 Презентации 1 строение атома
Презентации 1 строение атома Терпеноиды. Эфирные масла
Терпеноиды. Эфирные масла Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Липиды. Источники
Липиды. Источники Презентация на тему Знакомство с кислотами
Презентация на тему Знакомство с кислотами  Биотит и тальк
Биотит и тальк Современные химические топливные элементы
Современные химические топливные элементы Комплексное задание по дисциплине основы материаловедения для группы 18
Комплексное задание по дисциплине основы материаловедения для группы 18 Обобщение знаний по теме атомы химических элементов. Химическая связь
Обобщение знаний по теме атомы химических элементов. Химическая связь Первоначальные сведения о строение вещества
Первоначальные сведения о строение вещества Silīcija savienojumi
Silīcija savienojumi Конденсированные гетероциклы. Нуклеотиды. Нуклеиновые кислоты
Конденсированные гетероциклы. Нуклеотиды. Нуклеиновые кислоты Презентация на тему Обобщение: предельные и непредельные углеводороды
Презентация на тему Обобщение: предельные и непредельные углеводороды  Углеводороды. Изомеры и гомологи
Углеводороды. Изомеры и гомологи Сельскохозяйственная токсикология
Сельскохозяйственная токсикология Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70
Исследование свойств модельной смеси сополимера Акритана-С с ЛД-70 Отжиг сталей (отжиг 2-го рода) Лекция 2
Отжиг сталей (отжиг 2-го рода) Лекция 2 Физические свойства металлов
Физические свойства металлов Практическая работа по теме Получение и свойства соединений металлов
Практическая работа по теме Получение и свойства соединений металлов Металлы общая характеристика
Металлы общая характеристика Оксиды. Сложные вещества
Оксиды. Сложные вещества Создание полупроводниковых структур методами химического осаждения из истинных и коллоидных растворов
Создание полупроводниковых структур методами химического осаждения из истинных и коллоидных растворов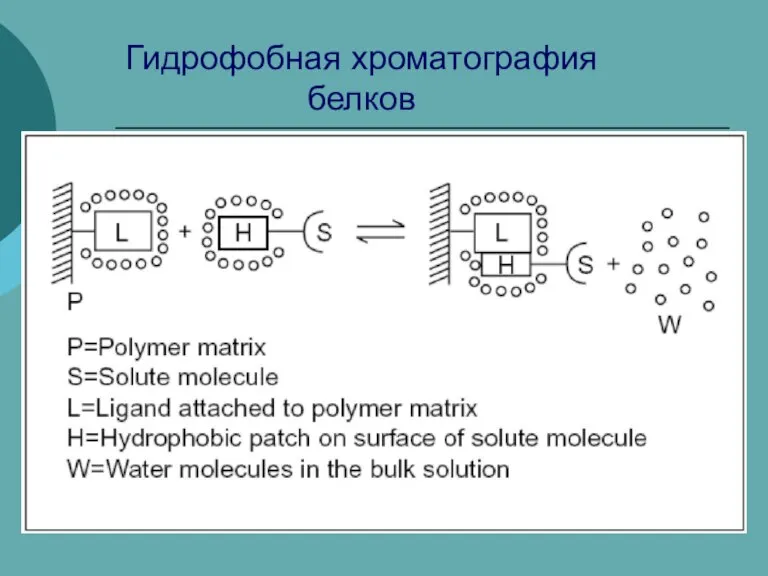 Гидрофобная хроматография белков
Гидрофобная хроматография белков Комплексные соединения
Комплексные соединения Газоанализаторы. Измерительный прибор для определения качественного и количественного состава смесей газов
Газоанализаторы. Измерительный прибор для определения качественного и количественного состава смесей газов Химические реакции. Вещество
Химические реакции. Вещество Окислительно-восстановительные реакции (часть 2)
Окислительно-восстановительные реакции (часть 2) Порядок в жидкостях
Порядок в жидкостях