Слайд 2План
1. Предмет химической кинетики. Скорость химической реакции.
2. Механизм химической реакции. Реакции

простые и сложные.
3. Факторы, влияющие на скорость химической реакции:
4. Молекулярность и порядок реакций.
Слайд 3Определение скорости химического процесса, измерение всех факторов влияющих на эту скорость, выяснение

механизма процесса является предметом химической кинетики.
Скорость химической реакции - количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема системы.
В гомогенных реакциях все взаимодействующие вещества находятся в одной фазе (газовой, жидкой или твердой).
Слайд 4А + В = С + Д
где ν - скорость реакции (моль/л
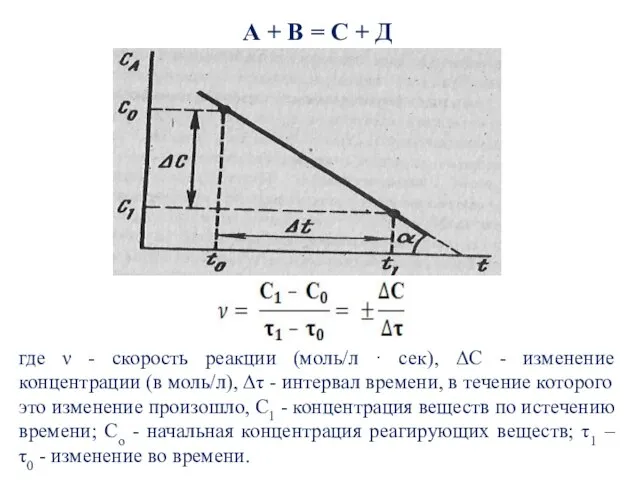
· сек), ΔC - изменение концентрации (в моль/л), Δτ - интервал времени, в течение которого это изменение произошло, С1 - концентрация веществ по истечению времени; Со - начальная концентрация реагирующих веществ; τ1 – τ0 - изменение во времени.
Слайд 5Гетерогенная химическая реакция протекает на границе раздела фаз.
где ν - скорость реакции

(моль/м2 · с); S - площадь поверхности соприкасающихся фаз; n - количество вещества, вступающего в реакцию или образующегося в результате реакции.
Суммарная скорость гетерогенных процессов зависит от скорости отдельных стадий и определяется в первую очередь скоростью самой медленной стадии.
Слайд 6Элементарный акт реакции – либо распад одной частицы, либо одновременное взаимодействие двух

(в очень редких случаях трех) частиц, приводящих к перераспределению химических связей.
Простая реакция - химическая реакция, происходящая в одну стадию (элементарный акт).
Сложная реакция - если конечный продукт получается в результате осуществления двух и более простых реакций, с образованием промежуточных продуктов.
Кинетический механизм сложной реакции - совокупность стадий, через которые осуществляется эта реакция.
Слайд 7Последовательные – это реакции, в которых из исходных веществ образуются вначале промежуточные

продукты, а затем – конечные.
Параллельные - это реакции, когда одно или несколько веществ одновременно реагируют, образуя разные продукты.
Слайд 8Сопряженная – реакция, которая происходит только при условии одновременного протекания некоторой другой

реакции.
Пример: окисление С6Н6 и Н2О2, протекает медленно.
Вводим ион Fe2+ (FeSO4→Fe2+ + SO42-)
1) Fe2+ + H2O2 → Fe3+ + OH- – окисление идет быстро.
2) С6Н6 + OH- → H2O + С6Н5 – быстро
3) С6Н5 + ОН → C6H5OH – быстро
Слайд 9Влияние природы реагирующих частиц определяется их атомным составом, пространственным строением и молекулярными

свойствами.
Скорость химической реакции определяется скоростью разрыва одних и образованием других химических связей, чем больше энергия связи в молекуле, тем она менее реакционноспособна.
1. Взаимодействие органических веществ с ковалентными малополярными связями протекает медленнее, чем неорганических и некоторых органических веществ с ионными и полярными ковалентными связями.
2. Гомогенные реакции (кроме твердофазных) протекают быстрее, чем гетерогенные.
Слайд 10ЗДМ установлен К. Гульдбергом и П. Вааге.
При постоянной температуре скорость химической

реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
aA + bB → mM + nN
ν = k · CAa · CBb - кинетическое уравнение реакции:
где k - константа скорости химической реакции; CA и CB - концентрации реагентов A и B; a и b - стехиометрические коэффициенты.
k определяется природой реагирующих веществ и зависит от температуры, от присутствия катализатора, но не зависит от концентрации веществ, участвующих в реакции.
Слайд 11Гетерогенные процессы связаны с переносом вещества.
1 стадия - приближение реагентов к

поверхности раздела фаз;
2 стадия - химическая реакция;
3 стадия - отвод продуктов реакции от поверхности раздела фаз.
Лимитирующая стадия определяет скорость протекания реакции.
В гетерогенных системах в кинетическое уравнение входят концентрации только тех веществ, которые находятся в газовой фазе или в растворе.
Вещества, находящиеся в твердом состоянии не учитываются, т.к. реакция протекает на поверхности раздела фаз, которая остается неизменной.
Слайд 12Уравнения Клапейрона - Менделеева
р = СRT
Изменение давления каждого из компонентов

газовой смеси, оказывает на скорость газовой реакции то же влияние, что и пропорциональное ему изменение концентрации этого же компонента.
2NO(г) + Н2(г) ⇄ N2О(г) + Н2О(г)
ν1 = k1р2(NO)p(H2) ⇄ k2р(N2O)p(H2O)
где р(NO), p(H2), р(N2O), p(H2O) – парциальные давления NO, H2, N2O и H2O соответственно.
Слайд 13Правило Вант-Гоффа:
При повышении температуры на каждые 10º, скорость реакции увеличивается в

2 - 4 раза.
γ - температурный коэффициент скорости реакции (число, во сколько раз увеличивается скорость реакции при повышении температуры на каждые 10º).
k - константа скорости химической реакции;
t - температура
Слайд 14В химическое взаимодействие вступают только активные молекулы, обладающие энергией, достаточной для осуществления

данной реакции.
Энергия, которую надо сообщить молекулам (частицам) реагирующих веществ, чтобы превратить их в активные, -энергия активации (Е).
Величина Е - зависит от природы реагирующих веществ.
Уравнение Аррениуса:
k - константа скорости; А – предэкспоненциальный множитель, постоянный для данной реакции, отражает количественную взаимосвязь между константой скорости реакции, температурой и энергией активации; е – основание натуральных логарифмов (2,7); Е – энергия активации (кДж/моль) ; R - газовая постоянная; Т – абсолютная температура.
Слайд 15Катализ – изменение скорости химической реакции, благодаря присутствию в системе особых веществ

(катализаторов), химический состав и масса которых в конце реакции остаются неизменными.
Катализ положительный - если катализаторы увеличивают скорость реакции, отрицательный - если скорость реакции уменьшается.
Химические ингибиторы - вещества, тормозящие различные химические процессы.
Если каталитическим действием обладает один из продуктов реакции, то процесс - автокаталитический.
Гомогенный катализ - реагирующие вещества и катализатор находятся в одной фазе.
А + Б = АБ (протекает медленно)
А + К = АК (протекает быстро)
АК + Б = АБ + К (протекает быстро)
Гетерогенный катализ - если реагирующие вещества и катализатор находятся в разных фазах.
Слайд 16Ферментативный катализ (биокатализ) - ускорение химических реакций под влиянием ферментов.
Ферменты - белковые

молекулы, которые катализируют химические реакции в биологических системах.
Белковые молекулы содержат один или несколько активных центров, где и происходит превращение субстратов.
Особенности ферментов:
- проявляют каталитическую активность в довольно мягких условиях температур, давлений и кислотности среды;
- обладают способностью ускорять реакцию только между определенными веществами - субстратами.
Слайд 17Математическая модель ферментативного катализа Л. Михаэлиса и М. Ментена.
Е – субстрат;
S –

субстрат, подвергающийся ферментативной реакции;
Р – образующийся в результате продукт;
ES – фермент-субстратный комплекс;
К1, К2 – константы скорости индивидуальных реакций.
Уравнение имеет вид:
Vm - максимальная скорость реакции, равная kcatE0;
Kм - константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной;
S - концентрация субстрата.
Слайд 18Молекулярность реакции - количество частиц, принимающих участие в элементарном акте.
Мономолекулярная

реакция
А ⇄ С I2 → 2I.
Бимолекулярная реакция
2А ⇄ С или А + В ⇄ С Н2 + I2 → 2НI
Тримолекулярные реакции
А + 2В ⇄ С или А + В + С ⇄ D
2NO + O2 → 2NO2
Слайд 19Порядок реакции определяется кинетическим уравнением реакции, выражающим зависимость скорости реакции от концентрации

реагирующих веществ, и равен сумме показателей степеней при концентрациях в этом уравнении.
Скорость реакций нулевого порядка
υ = k
Скорость реакций первого порядка
СН3ОСН3 → СН4 + СО + Н2 (мономолекулярная реакция)
ν = k · С1СН3ОСН3 (реакция первого порядка)
Скорость реакций второго порядка
СН3СООСН3 + NаОН → СН3СООNа + СН3ОН
(бимолекулярная реакция)
ν = k · C1СН3СООСН3 · C1NаОН (реакция второго порядка)


















 Электролиз расплавов и растворов электролитов
Электролиз расплавов и растворов электролитов Презентация по Химии "Незнайка в стране химия"
Презентация по Химии "Незнайка в стране химия"  Аналитические методы контроля в техносферной безопасности. Лекция 1
Аналитические методы контроля в техносферной безопасности. Лекция 1 Основные химические законы
Основные химические законы Понятие о химической реакции. Реакции, идущие без изменения состава веществ. 11 класс
Понятие о химической реакции. Реакции, идущие без изменения состава веществ. 11 класс Русские ученые- химики
Русские ученые- химики Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды
Ресурс Лови оксиды для систематизации знаний, умений, навыков по теме Оксиды Металлы
Металлы Презентация на тему Белки
Презентация на тему Белки  Массовые доли растворенного вещества
Массовые доли растворенного вещества Сследование коэффициентов переноса жидкостей в молекулярных моделях opls и saft
Сследование коэффициентов переноса жидкостей в молекулярных моделях opls и saft Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини
Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини Вода
Вода Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов
Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов История создания термометра: как придумали первый градусник?
История создания термометра: как придумали первый градусник? Индолы. Cтроение индола
Индолы. Cтроение индола Перманганатометрия и комплексонометрия
Перманганатометрия и комплексонометрия Аэрозоли и аэродисперсии
Аэрозоли и аэродисперсии Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова
Методы очистки воды от тяжелых металлов Выполнила: студентка 4 курса 41 группы естественно-географического факультета Кузнецова Реакции ионного обмена
Реакции ионного обмена Капиллярное поднятие жидкости
Капиллярное поднятие жидкости 4. Диаграмма железо-углерод
4. Диаграмма железо-углерод Ароматические и ненасыщенные альдегиды и кетоны
Ароматические и ненасыщенные альдегиды и кетоны Химическая связь
Химическая связь Решение 33 задания
Решение 33 задания Водные биоресурсы и аквакультура. Расчеты в объемном анализе
Водные биоресурсы и аквакультура. Расчеты в объемном анализе Основания. Растворимые (гидроксиды щелочных и щелочноземельных металлов). Нерастворимые
Основания. Растворимые (гидроксиды щелочных и щелочноземельных металлов). Нерастворимые Поливинилхлорид
Поливинилхлорид