Содержание
- 2. История Сильная двухосновная кислота, отвечающая высшей степени окисления серы. При обычных условиях концентрированная серная кислота -
- 3. Физические свойства Na2SO4 Чистая серная кислота или моногидрат - это бесцветная маслянистая жидкость, которая застывает в
- 4. Химические свойства Na2SO4 Серная кислота жадно поглощает пары воды и поэтому часто применяется для осушения газов.
- 5. Получение Na2SO4 Серная кислота — самый важный промышленный химикат и самая дешевая из производимых в большом
- 7. Скачать презентацию
Слайд 2История
Сильная двухосновная кислота, отвечающая высшей степени окисления серы.
При обычных условиях концентрированная
История
Сильная двухосновная кислота, отвечающая высшей степени окисления серы.
При обычных условиях концентрированная

В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO₃.
Если молярное отношение SO₃ : H₂O 1 - раствор SO₃ в серной кислоте.
Слайд 3Физические свойства Na2SO4
Чистая серная кислота или моногидрат - это бесцветная маслянистая
Физические свойства Na2SO4
Чистая серная кислота или моногидрат - это бесцветная маслянистая

Свойства концентрированной серной кислоты разнообразны. Например, при растворении этой кислоты в воде будет выделено большое количество теплоты (19ккал/моль) вследствие образования гидратов. Эти гидраты можно выделить из раствора при низких температурах в твердом виде.
Серная кислота - это один из самых основных продуктов в химической промышленности. Она предназначена для производства минеральных удобрений (сульфат аммония, суперфосфат), разнообразных солей и кислот, моющих и лекарственных средств, искусственных волокон, красителей, взрывчатых веществ. Также серная кислота имеет применение в металлургии (например, разложение урановых руд), для очистки нефтепродуктов, для осушки газов и так далее.
Слайд 4Химические свойства Na2SO4
Серная кислота жадно поглощает пары воды и поэтому часто применяется
Химические свойства Na2SO4
Серная кислота жадно поглощает пары воды и поэтому часто применяется

Концентрированная серная кислота, особенно горячая, — энергичный окислитель. Она окисляет HI и HBr (но не HCl) до свободных галогенов, уголь – до CO2, серу – до SO2. Указанные реакции выражаются уравнениями:
8HI + H2SO4 = 4I2 + H2S↑ + 4H2O;
2HBr + H2SO4 = Br2 + SO2↑ + 2H2O;
C + 2H2SO4 = CO2↑ + 2SO2↑ + 2H2O;
S + 2H2SO4 = 3SO2 + 2H2O.
Взаимодействие серной кислоты с металлами протекает различно в зависимости от её концентрации. Разбавленная серная кислота окисляет своим ионом водорода. Поэтому она взаимодействует только с теми металлами, которые стоят в ряду напряжений только до водорода, например:
Zn + H2SO4 = ZnSO4 + H2↑.
Однако свинец не растворяется в разбавленной кислоте, поскольку образующаяся соль PbSO4 нерастворима.
Слайд 5Получение Na2SO4
Серная кислота — самый важный промышленный химикат и самая дешевая из
Получение Na2SO4
Серная кислота — самый важный промышленный химикат и самая дешевая из

Концентрированную серную кислоту («купоросное масло») сначала получали нагреванием «зеленого купороса» FeSO4×nH2O и расходовали в большом количестве на получение Na2SO4 и NaCl.
В современном процессе получения серной кислоты используется катализатор, состоящий из оксида ванадия(V) с добавкой сульфата калия на носителе из диоксида кремния или кизельгура. Диоксид серы SO2 получают сжиганием чистой серы или при обжиге сульфидной руды (прежде всего пирита или руд Си, Ni и Zn) в процессе извлечения этихметаллов. Затем SO2 окисляют до триоксида, а потом путем растворения в воде получают серную кислоту:
S + O2→ SO2 (ΔH0 — 297 кДж/моль);
SO2 + ½ O2→ SO3 (ΔH0 — 9,8 кДж/моль);
SO3 + H2O → H2SO4 (ΔH0 — 130 кДж/моль).
 Презентация на тему Строение и свойства циклоалканов
Презентация на тему Строение и свойства циклоалканов  Кальций и его соединения
Кальций и его соединения Электроосмос. Практическое применение электроосмоса
Электроосмос. Практическое применение электроосмоса Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты)
Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты) Оксиды углерода
Оксиды углерода Повторение классов соединений. Составление формул по названиям
Повторение классов соединений. Составление формул по названиям Судьба углеродного скелета аминокислот
Судьба углеродного скелета аминокислот Углеводы: моно-, ди-, полисахариды
Углеводы: моно-, ди-, полисахариды Общая характеристика элементов А-группы
Общая характеристика элементов А-группы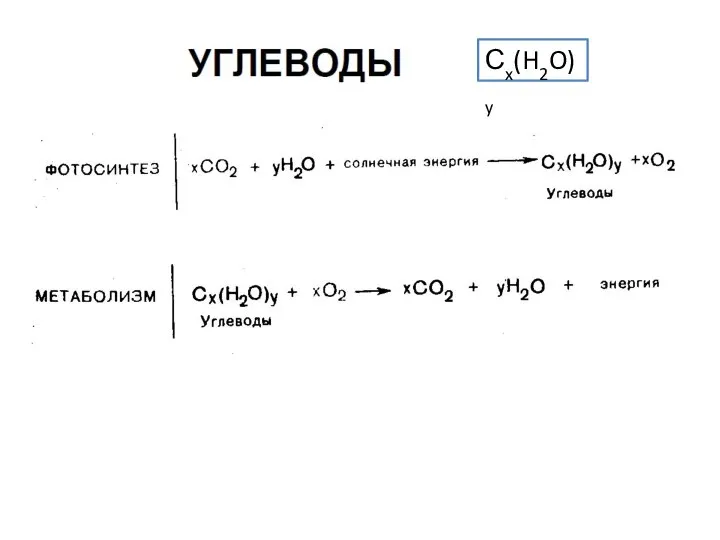 Углеводы. Классификация, cтроение
Углеводы. Классификация, cтроение История развития органической химии. 10 класс
История развития органической химии. 10 класс Решение экспериментальных задач по теме Подгруппы азота и углерода
Решение экспериментальных задач по теме Подгруппы азота и углерода Сера и ее соединения
Сера и ее соединения Физика полимеров Ч1
Физика полимеров Ч1 Медь и её сплавы
Медь и её сплавы Реакции соединения и разложения
Реакции соединения и разложения Нафтены и арены
Нафтены и арены Нефть. Способы переработки нефти
Нефть. Способы переработки нефти Алгебраический метод решения задач В-9 – элемент решения задач С4
Алгебраический метод решения задач В-9 – элемент решения задач С4 Химия. Вещества. 8 класс
Химия. Вещества. 8 класс Виды химической связи
Виды химической связи Презентация на тему Нефть. Переработка нефти
Презентация на тему Нефть. Переработка нефти  Управления реакций
Управления реакций Нуклеиновые кислоты
Нуклеиновые кислоты Валентность. Определение валентности элемента в оксиде
Валентность. Определение валентности элемента в оксиде Альдегиды. Строение молекул
Альдегиды. Строение молекул Растворы. Виды выражения концентрации
Растворы. Виды выражения концентрации Физико-химические методы анализа. Лекция 4
Физико-химические методы анализа. Лекция 4