персидский химик Аль- Рази. В России долгое время она называлась «купоросным маслом», поскольку выделяли ее из «купоросов» (солей).
Азотная и соляная кислоты были получены в чистом виде и классифицированы спустя несколько веков. В больших масштабах эти кислоты стали производить в 17 веке и так как делали это посредством серной кислоты, то присвоили ей почетный титул
« матери всех кислот».
Смесь двух кислот азотной и соляной в пропорции 1 к 3, представляет собой жидкость желтого цвета и обладает уникальной способностью растворять многие благородные металлы (золото, платину), за что получила название «Царской водки».








 Производные фенола: танины
Производные фенола: танины Подгруппа кислорода. Решение экспериментальных задач
Подгруппа кислорода. Решение экспериментальных задач Подготовка проб товаров к анализу. Химико-аналитический контроль
Подготовка проб товаров к анализу. Химико-аналитический контроль Гетерофункциональные органические соединения
Гетерофункциональные органические соединения Структура периодической таблицы элементов
Структура периодической таблицы элементов Гемоглобин. Структура и свойства молекулы гемоглобина
Гемоглобин. Структура и свойства молекулы гемоглобина Амины. Аминокислоты
Амины. Аминокислоты Ковалентная химическая связь
Ковалентная химическая связь Научный эксперимент в химической технологии
Научный эксперимент в химической технологии Применение личностно-ориентированного подхода в обучении химии
Применение личностно-ориентированного подхода в обучении химии Соли: классификация, получение, номенклатура
Соли: классификация, получение, номенклатура Пултаруллă
Пултаруллă Svins. Iegūšana
Svins. Iegūšana Окисники, відновники
Окисники, відновники Химический состав живых организмов. Метаболизм
Химический состав живых организмов. Метаболизм Презентация на тему Применение солей в быту
Презентация на тему Применение солей в быту  Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Алюминий и его соединения
Алюминий и его соединения Химическая термодинамика. Термодинамические потенциалы
Химическая термодинамика. Термодинамические потенциалы Сложные эфиры. Жиры
Сложные эфиры. Жиры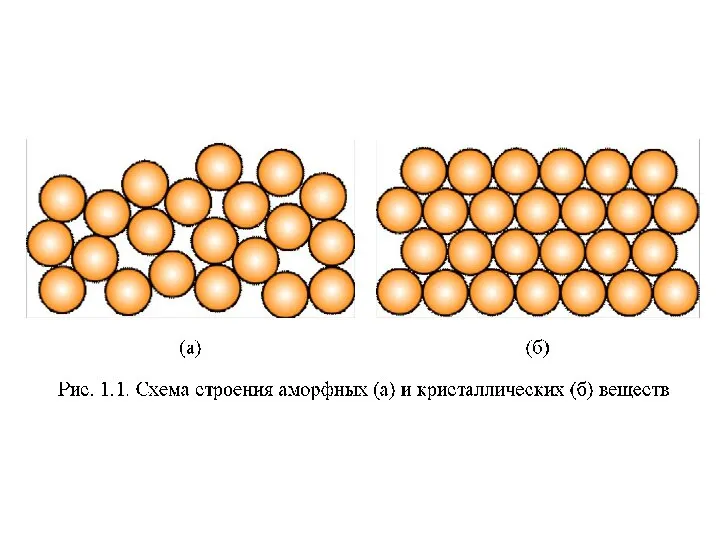 Материаловедение
Материаловедение Виды химической связи
Виды химической связи Фосфор. Элемент жизни и мысли
Фосфор. Элемент жизни и мысли Окислительно-восстановительные реакции (часть 2)
Окислительно-восстановительные реакции (часть 2) Химия һәм сәламәт яшәү рәвеше
Химия һәм сәламәт яшәү рәвеше Презентация на тему Химия вокруг нас
Презентация на тему Химия вокруг нас  Химия и производство
Химия и производство