Содержание
- 2. Цілі: Спроби класифікацій хімічних елементів Періодична система хімічних елементів. Будова атому. Періодичний закон Д.І. Менделєєва. Біогарфія
- 3. Спроби класифікацій хімічних елементів В хімії існують класифікації елементів, речовин, хімічних реакцій Класифікація - це розподіл
- 4. В кінці ХVІІІ ст. А.-Л. Лавуазьє запропонував першу класифікацію хімічних елементів. Він розділив прості речовини на
- 5. Вчені об'єднали їх в окремі групи. Прості речовини кожної групи отримали такі загальні назви:
- 6. У ХІХ ст. німецький вчений В. Деберейнер розподілив частину подібних елементів на тріади. 1 тріада -
- 7. Він помітив, що в багатьох випадках кожний восьмий елемент є подібним до обраного за перший (таку
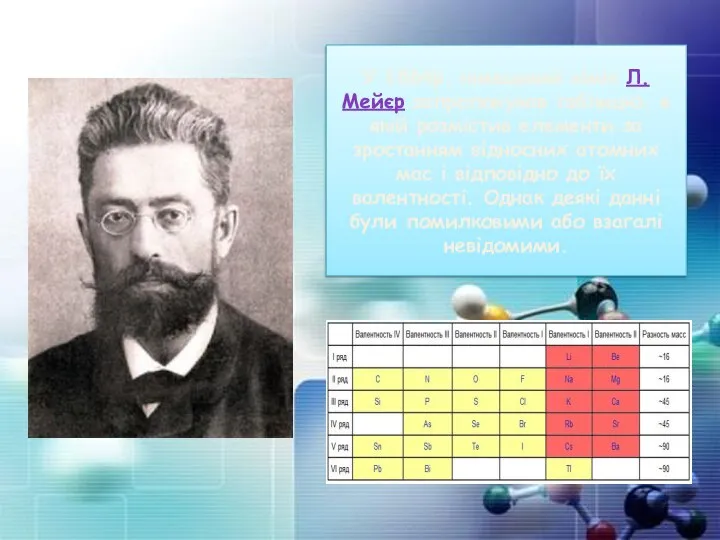
- 8. У 1864р. німецький хімік Л.Мейєр запропонував таблицю, в якій розмістив елементи за зростанням відносних атомних мас
- 9. Періодична система Д.І. Менделеева. Історія відкриття періодичного закону. «Познавая бесконечное, наука сама бесконечна» Д.І.Менделєєв
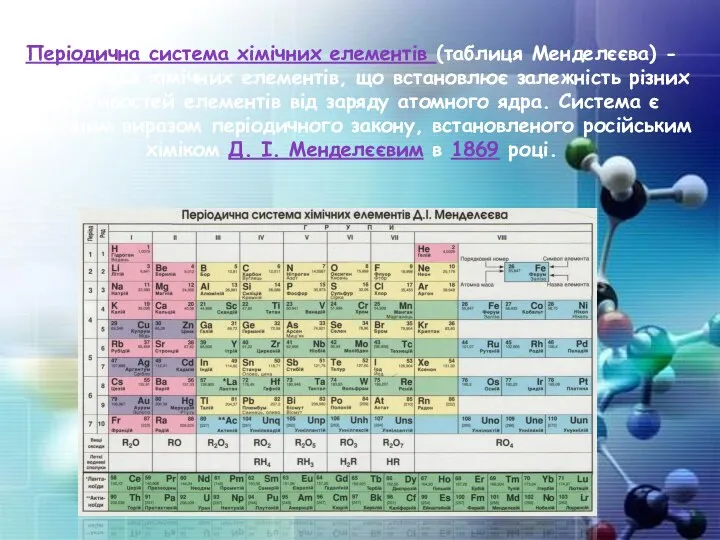
- 10. Періодична система хімічних елементів (таблиця Менделєєва) - класифікація хімічних елементів, що встановлює залежність різних властивостей елементів
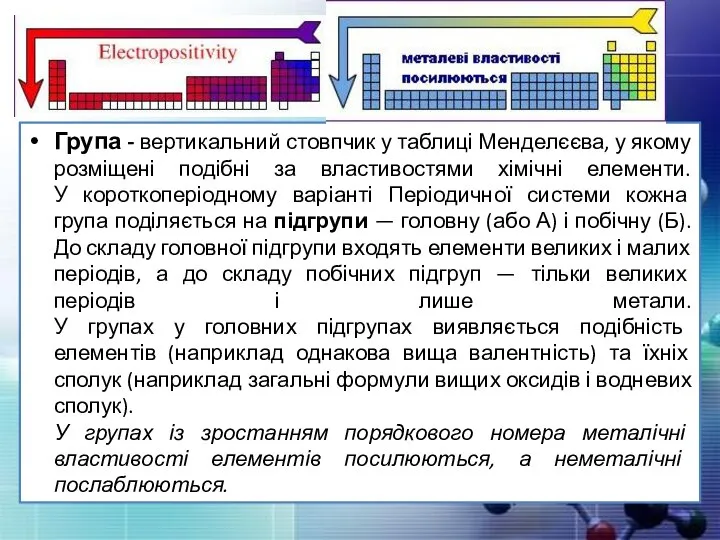
- 11. Група - вертикальний стовпчик у таблиці Менделєєва, у якому розміщені подібні за властивостями хімічні елементи. У
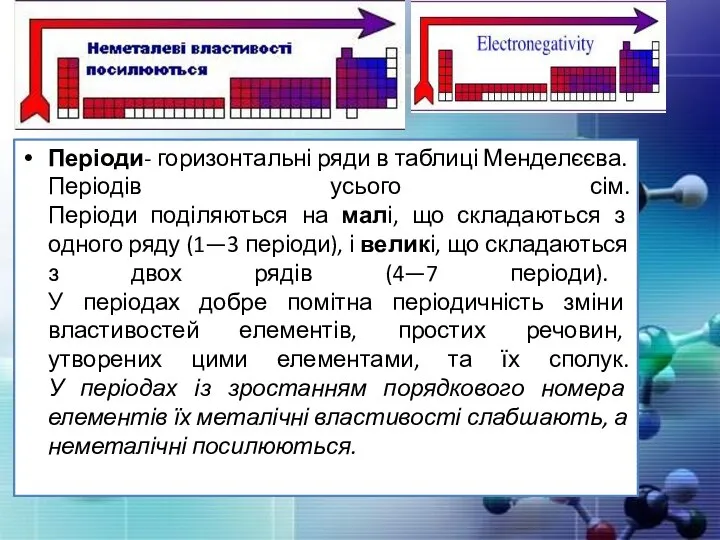
- 12. Періоди- горизонтальні ряди в таблиці Менделєєва. Періодів усього сім. Періоди поділяються на малі, що складаються з
- 13. Інформацію про будову атома дає: Порядковий номер елементу Номер групи Номер періоду Можна визначити, користуючись таблицею
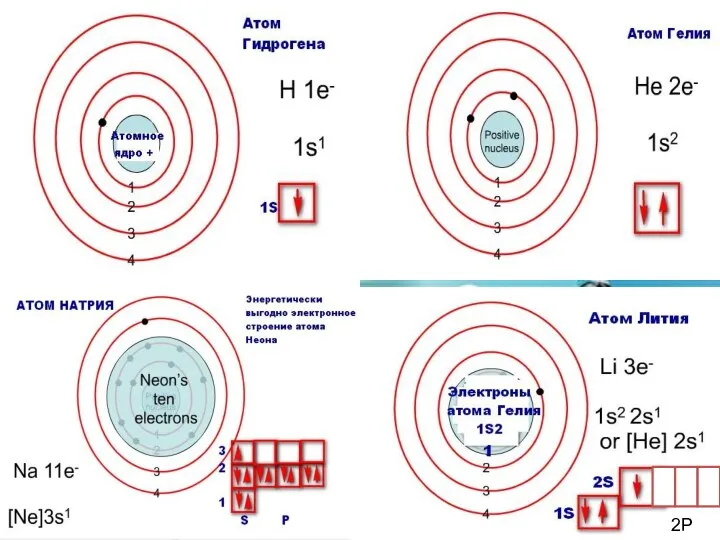
- 14. Теорія будови атома Атом — це електронейтральна частинка, що складається з позитивно зарядженого ядра, нейтральних часток
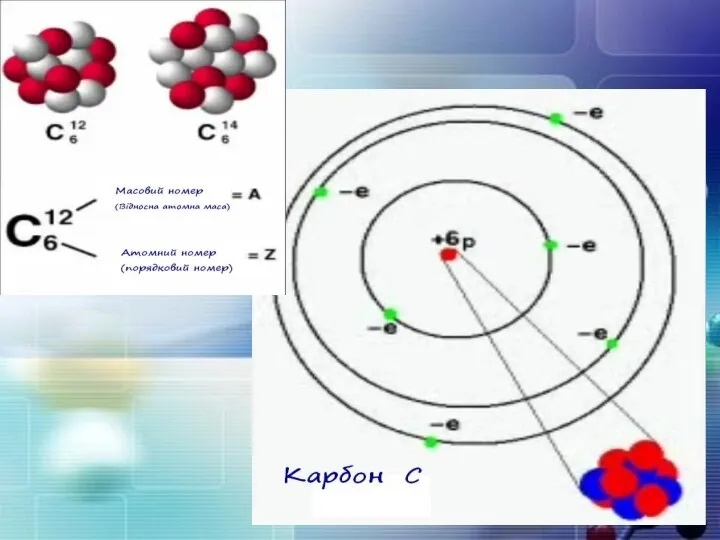
- 15. Маси протона та нейтрона приблизно однакові, їх приймають рівними 1 Атоми з однаковим зарядом ядра складають
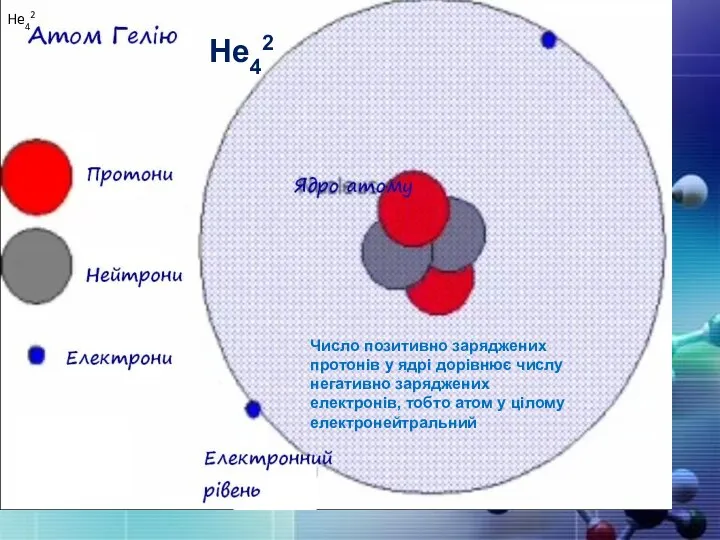
- 16. He42 He42 Число позитивно заряджених протонів у ядрі дорівнює числу негативно заряджених електронів, тобто атом у
- 17. Порядковий номер елементу – загальне число електронів у атомі, які утворюють електронну оболонку атома. Порядковий номер
- 18. Розподіл електронів по енергетичним рівням Третій період 3 енергетичних рівня n=3 кількість орбіталей n2=9 електронів 2
- 19. 2Р
- 21. Фізичний зміст Періодичного закону В атомах елементів із зростанням порядкового номера відбувається збільшення кількості протонів у
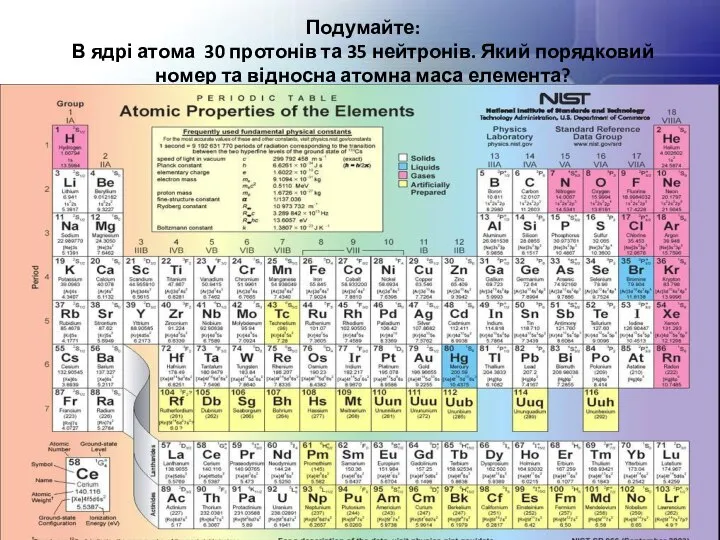
- 22. Подумайте: В ядрі атома 30 протонів та 35 нейтронів. Який порядковий номер та відносна атомна маса
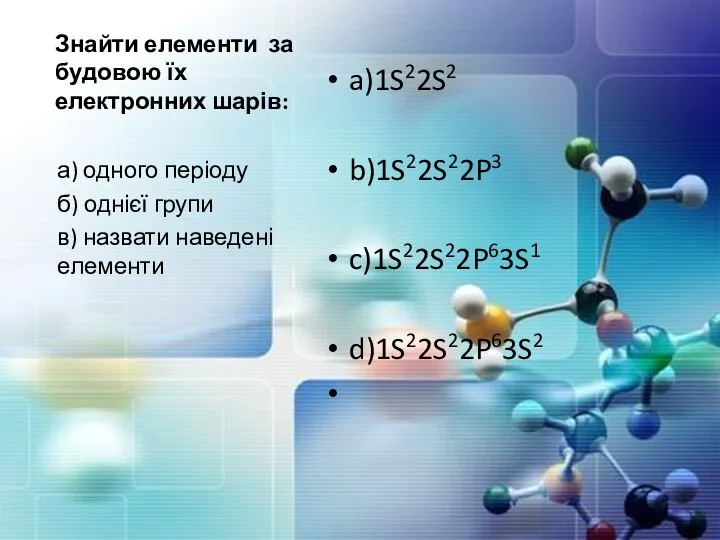
- 24. Знайти елементи за будовою їх електронних шарів: a)1S22S2 b)1S22S22P3 c)1S22S22P63S1 d)1S22S22P63S2 а) одного періоду б) однієї
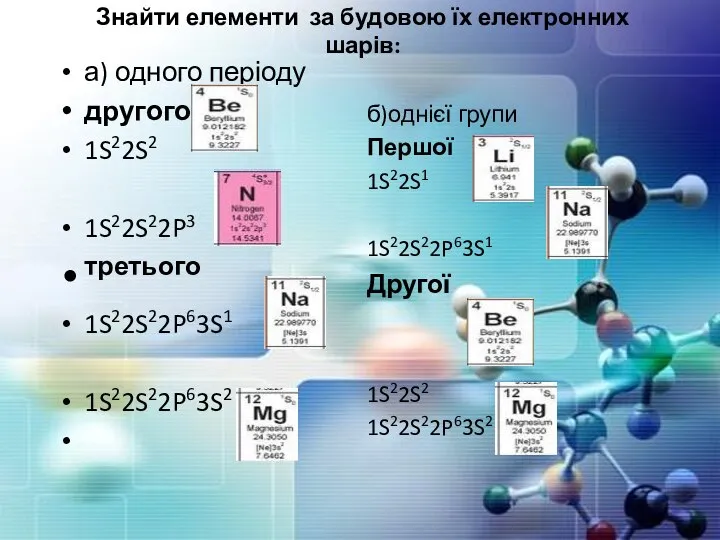
- 25. Знайти елементи за будовою їх електронних шарів: а) одного періоду другого 1S22S2 1S22S22P3 третього 1S22S22P63S1 1S22S22P63S2
- 26. Періодичний закон відкритий Д. І. Менделєєвим в березні 1869 року при зіставленні властивостей всіх відомих на
- 27. Д.І.Менделєєв
- 28. Дмитро Іванович Менделєєв народився 8 лютого1834 року у Тобольську, у родині директора місцевої гімназії. З 1850
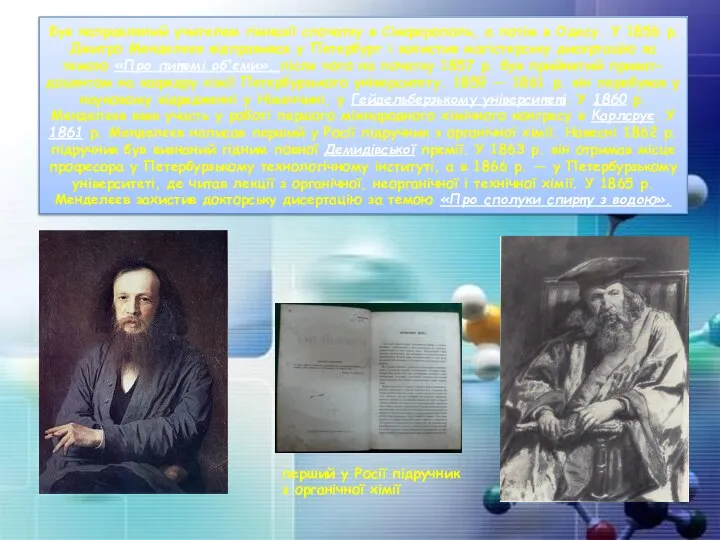
- 29. Був направлений учителем гімназії спочатку в Сімферополь, а потім в Одесу. У 1856 р. Дмитро Менделєєв
- 30. Феозва Микитична Лещова, Дружина Менделєєва, 1860-е роки Ганна Іванівна Попова, Друга дружина Менделєєва
- 31. Дочка Д.І.Менделєєва – Ольга Трирогова та його внучка Наталя Дочка Менделєєва Люба та її чоловік
- 32. У наступні роки з-під пера Менделєєва вийшло ще кілька основних праць з різних розділів хімії. Його
- 34. Скачать презентацию




















 Презентация на тему Жизнь Д.И.Менделеева
Презентация на тему Жизнь Д.И.Менделеева  Важнейшие классы неорганических соединений. Соли
Важнейшие классы неорганических соединений. Соли Природные источники углеводородов
Природные источники углеводородов Углерод и его соединения
Углерод и его соединения ЭОР в преподавании химии
ЭОР в преподавании химии Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение
Группа веществ, требующих особых методов изолирования. Характеристика соединений. Токсикологическое значение Химические соединения в живых организмах. Неорганические вещества
Химические соединения в живых организмах. Неорганические вещества Необратимый (совместный) гидролиз
Необратимый (совместный) гидролиз Презентация на тему Массовая доля вещества в растворе
Презентация на тему Массовая доля вещества в растворе  Особо чистые вещества. Занятие 12
Особо чистые вещества. Занятие 12 Подготовка учащихся к государственной (итоговой) аттестации по химии
Подготовка учащихся к государственной (итоговой) аттестации по химии Жесткость воды и способы ее устранения
Жесткость воды и способы ее устранения Фосфор. Элемент жизни и мысли
Фосфор. Элемент жизни и мысли Спирты
Спирты Открытый урок химии. Типы химических реакций
Открытый урок химии. Типы химических реакций Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции
Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции Реакции обмена
Реакции обмена Железо
Железо Введение в метаболизм
Введение в метаболизм Primenenie_kauchukov
Primenenie_kauchukov Нефть. Способы переработки нефти
Нефть. Способы переработки нефти Типы кристаллических структур Автор Могилевская А.Е. Санкт-Петербург. ГБОУ СОШ№535
Типы кристаллических структур Автор Могилевская А.Е. Санкт-Петербург. ГБОУ СОШ№535 Углеводы. Полисахариды. Важнейшие представители
Углеводы. Полисахариды. Важнейшие представители Загадочный фосфор
Загадочный фосфор Химические реакции. Подготовка к контрольной работе №2
Химические реакции. Подготовка к контрольной работе №2 Винилпиридиновые каучуки
Винилпиридиновые каучуки Алканы
Алканы Строение вещества
Строение вещества