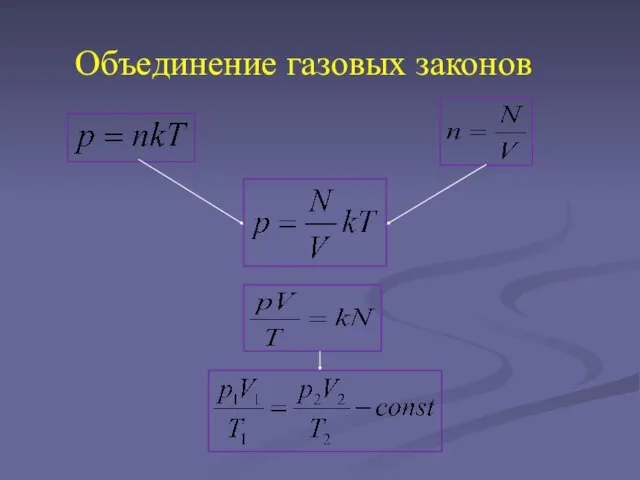
Слайд 2Уравнение Клапейрона
p V=BT
B-коэффициент пропорциональности
зависит от природы и массы тела

Слайд 4Уравнение Менделеева-Клапейрона.
Уравнение состояния идеального газа.
Д.И.Менделеев объединил уравнение Клапейрона с законом Авогадро, отнеся

уравнение к одному молю. От него можно перейти к произвольной массе газа.
PV=m\M*RT
М-масса одного моля вещества,R- универсальная газовая постоянная
Слайд 5PV=n R T
PV=n k T,
где n –концентрация молекул, число молекул

в единице объёма ,
k- постоянная Больцмана
PV= N k T
Слайд 6Задание№1.
Определите массу 5.6 аргона
при давлении 202.6 кПа и температуре.
Задание№2.
Определите плотность

воздуха при давлении 2 атм. и температуре 300К.
Слайд 7Решение к заданию №1.
Определяем объем аргона при н.у., используя для расчетов уравнения

и учитывая, что Т = 273+27=300К :
V0(Ar)=PVT0 / P0T
V(Ar)/22,4 л/моль;
v(Ar) = 10.2 / 22.4= 0.455 моль
Рассчитываем массу аргона :
m(Ar)= v(Ar)* M(Ar);
m(Ar)= 0.45V0(Ar)=(202.6 *5.6*273) / (300*101.3) = 10.2л
Количество аргона будет равно:
v(Ar)= 5 * 40 =18.2г
Слайд 8Решение к заданию №2.
Для расчетов выбираем образец воздуха количеством вещества 1 моль.

Молярная масса воздуха равна 29г/моль.
Тогда масса образца будет равна :
m(воздуха)=v(воздуха) * M(воздуха)
Объем воздуха при н.у. будет равен :
V0(воздуха)= v(воздуха)* 22.4 л/моль
V0(воздуха)= 1* 22.4=22.4 л.
Определяем объем воздуха при заданных условиях, используя уравнение
V(воздуха)=P0V0T / PT0
V(воздуха)=(1 * 22/4 * 300) / (2*273) = 12.3 л
Рассчитываем плотность воздуха при заданных условиях по уравнению
p( плотность воздуха)= m(воздуха) / V(воздуха)
p(плотность воздуха) = 29 / 12,3 = 2.36 г/л.
Слайд 13Список использованных источников:
а) Список используемых печатных источников
Д, И.Менделеев, Литературное наследство, т.1,1939, стр.68.
ЖРФХО

6(часть хим.) вып.7, отд.I,стр.208.
Д.И.Менделеев, Основы химии,8-е изд.,1905(по 13-му изд.1947г.), т.I,235,535.











 Вычисление массовой доли химического элемента в веществе
Вычисление массовой доли химического элемента в веществе Презентация на тему Типы химических реакций на примере свойств воды
Презентация на тему Типы химических реакций на примере свойств воды  Презентация на тему Сахароза
Презентация на тему Сахароза  Смог як хімічне явище
Смог як хімічне явище Альдегиды
Альдегиды Структура материалов
Структура материалов Первые химические символы
Первые химические символы Развитие ассоциативного мышления на уроках химии
Развитие ассоциативного мышления на уроках химии Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Металлы. Урок – обобщения
Металлы. Урок – обобщения Магматические горные породы
Магматические горные породы Презентация на тему Природные и синтетические красители и ароматизаторы
Презентация на тему Природные и синтетические красители и ароматизаторы  Уран гексафториді
Уран гексафториді Физические и химические явления в химии. Признаки химических реакций
Физические и химические явления в химии. Признаки химических реакций Тест по теме Альдегиды и кетоны
Тест по теме Альдегиды и кетоны Развитие энергетики и проблемы изменения структуры использования углеводородного сырья
Развитие энергетики и проблемы изменения структуры использования углеводородного сырья Исследование физико-химических свойств растворов сахарозы
Исследование физико-химических свойств растворов сахарозы Презентация на тему Таблица Менделеева и строение атома
Презентация на тему Таблица Менделеева и строение атома  Кислоты. Презентация к уроку химии в 8 классе
Кислоты. Презентация к уроку химии в 8 классе Эпоксидті полимер материалдарының қасиеттерін зерттеу
Эпоксидті полимер материалдарының қасиеттерін зерттеу Соли
Соли Введение в медицинскую химию: от молекулы к лекарству
Введение в медицинскую химию: от молекулы к лекарству Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Презентация на тему Азотная кислота и ее соли (9 класс)
Презентация на тему Азотная кислота и ее соли (9 класс)  Основи масообміну
Основи масообміну Липиды
Липиды Коррозия металлов
Коррозия металлов Инновационное производство синтетических мелкокодисперсных оксидов и оборудования для их изготовления
Инновационное производство синтетических мелкокодисперсных оксидов и оборудования для их изготовления