Содержание
- 2. Катионы Положительно (+) заряженные частицы
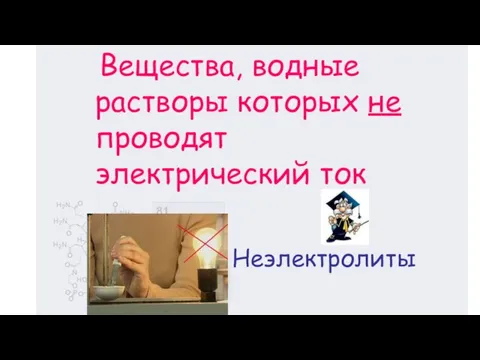
- 3. Неэлектролиты Вещества, водные растворы которых не проводят электрический ток
- 4. Анионы Отрицательно (-) заряженные частицы
- 5. Электролиты Вещества, водные растворы которых проводят электрический ток
- 6. Электролитическая диссоциация Процесс распада электролита на ионы
- 7. Кто автор теории электролитической диссоциации? В каком году была открыта эта теория? С. Аррениус; 1887 год.
- 8. Тема урока «Диссоциация кислот, оснований и солей» Определяем цели и задачи урока!
- 9. Осторожно: кислоты и щёлочи – едкие вещества. Разрушают ткани, раздражают кожу, слизистые оболочки.
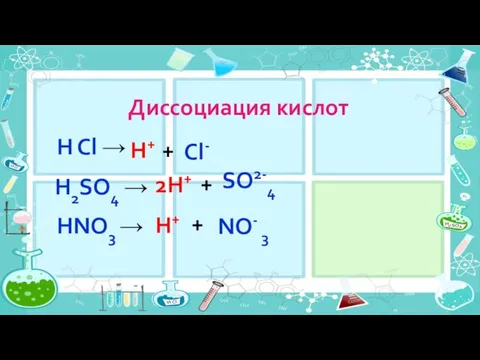
- 11. Диссоциация кислот 2H+ H Cl → H+ + Cl- H2SO4 → + SO2-4 HNO3 → H+
- 12. Многоосновные кислоты диссоциируют ступенчато H2SO4 ( серная кислота) 1) Образование гидросульфат ионов H2SO4 ↔ H+ +
- 14. Диссоциация оснований + NaOH → Na+ OH – 2OH – Ca(OH)2→ Ca2+
- 15. Ступенчатая диссоциация оснований Сa(OH)2 (гидроксид кальция) 1) Образование гидроксо-ионов кальция Сa(OH)2 ↔ OH- + СaOH+ 2)
- 17. Ca2+ Диссоциация солей NaCl → Na+ 2Na+ + + + Cl- Na2SO4 → SO2- 4 CaCl
- 18. Самостоятельная работа Напишите уравнения диссоциации следующих веществ: ZnCl2, Н3PO4, Al(NO3)3, Сu(OН)2 , K2SO3, KOН, BaSO4, FeCl3,
- 19. ВЕК ЖИВИ – ВЕК УЧИСЬ! Домашнее задание: 1). Проработать материал презентации, выучить определения; 2) Написать диссоциацию
- 21. Скачать презентацию
















 Нобелевские лауреаты и их достижения
Нобелевские лауреаты и их достижения Классификация органических веществ Химия. 10 класс Абрамова С.И.
Классификация органических веществ Химия. 10 класс Абрамова С.И. Тайна алмазов
Тайна алмазов Здравствуйте, химия! Что изучает химия
Здравствуйте, химия! Что изучает химия Альдегиды и кетоны
Альдегиды и кетоны Новогодний Пробник №190415
Новогодний Пробник №190415 Методы получения нафтиридинов (всех изомеров)
Методы получения нафтиридинов (всех изомеров) Галогеноводородные кислоты
Галогеноводородные кислоты Сложные эфиры. Организация внеаудиторной творческой работы учащихся
Сложные эфиры. Организация внеаудиторной творческой работы учащихся Растворимость веществ. Кристаллогидраты
Растворимость веществ. Кристаллогидраты Валентность и ковалентность химической связи
Валентность и ковалентность химической связи Протолитические буферные системы. Буферные системы организма, их взаимодействие
Протолитические буферные системы. Буферные системы организма, их взаимодействие Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Строение атома. Периодический закон
Строение атома. Периодический закон Строение атома. История открытия атома
Строение атома. История открытия атома Подготовка учащихся к государственной (итоговой) аттестации по химии
Подготовка учащихся к государственной (итоговой) аттестации по химии Физика твердого тела. Введение в кристаллографию. Построение стереографических проекций
Физика твердого тела. Введение в кристаллографию. Построение стереографических проекций Строение и физические свойства металлов
Строение и физические свойства металлов Металловедение
Металловедение Презентация на тему Массовая доля вещества в растворе
Презентация на тему Массовая доля вещества в растворе  Химия металлов. Влияние металлов на организм человека
Химия металлов. Влияние металлов на организм человека Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Строение и свойства этилена
Строение и свойства этилена Карбоновые кислоты
Карбоновые кислоты Теория электролитической диссоциации
Теория электролитической диссоциации Алкены (часть 2)
Алкены (часть 2) Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН
Алмаз Подготовила: УЧЕНИЦА 9 «А» КЛАССА КАЗИЕВА МАРЖАН ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.