Содержание
- 2. Содержание раздела: Тема 1. Основные положения МКТ
- 3. Тема 1. Основные положения МКТ
- 4. Основные понятия Молекулярная физика – раздел физики, изучающий зависимости строения и физических свойств тел от характера
- 5. Основные понятия Атомом называют наименьшую частицу данного химического элемента. Молекулой называют наименьшую устойчивую частицу данного вещества,
- 6. Электронный микроскоп 1. Все тела состоят из мельчайших частиц – атомов, молекул, в состав которых входят
- 7. Мультфильм Исследователи, работающие в компании IBM, создали мультфильм, манипулируя отдельными атомами. Анимационная лента «Мальчик и его
- 8. 2. Атомы и молекулы вещества всегда находятся в непрерывном хаотическом (беспорядочном) движении. Основные положения МКТ Диффузия
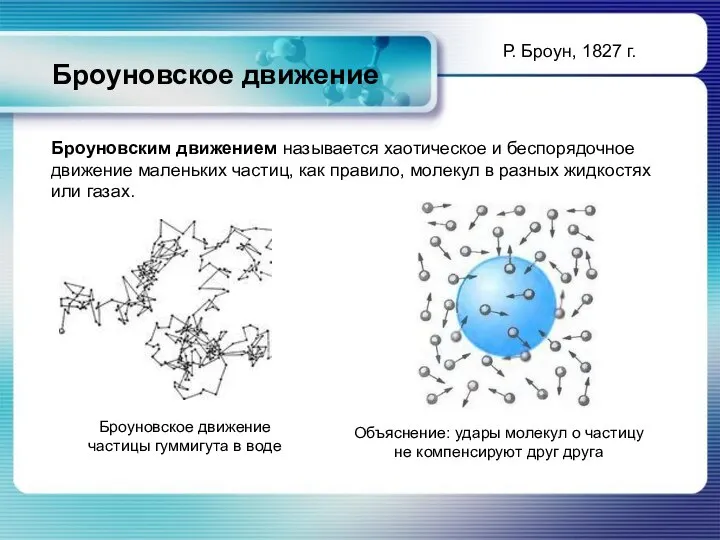
- 9. Броуновское движение Броуновское движение частицы гуммигута в воде Объяснение: удары молекул о частицу не компенсируют друг
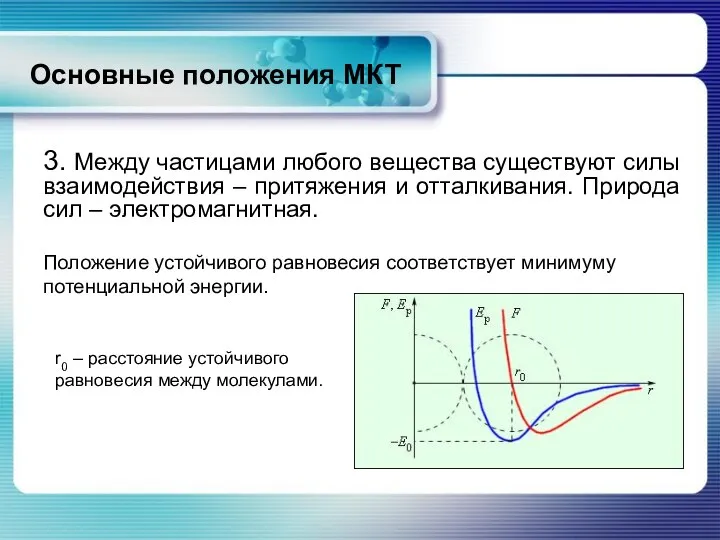
- 10. 3. Между частицами любого вещества существуют силы взаимодействия – притяжения и отталкивания. Природа сил – электромагнитная.
- 11. Масса молекул Mr - относительная молекулярная масса, безразмерная величина, равная отношению массы молекулы к 1/12 массы
- 12. Количество вещества Количество вещества ν — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в данной
- 13. Закрепление Задание 2 Определите молярную массу следующих веществ: аммиак, гелий, органического соединения (C3H6O)2. Задание 4 Поместятся
- 14. Тема 2. Идеальный газ
- 15. Строение газообразных, жидких и твёрдых тел Газы. Частицы газа не связаны молекулярными силами притяжения и движутся
- 16. Идеальный газ. Параметры состояния Идеальным газом называют такой газ, для которого можно пренебречь размерами молекул, силами
- 17. Параметры состояния идеального газа Объём газа V всегда совпадает с вместимостью сосуда, который он занимает, единица
- 18. Температура Температура – физическая величина, характеризующая степень нагретости тела. Состояние системы тел, при котором теплообмен между
- 19. Температурные шкалы Прибор для измерения температуры называют термометром. Эти шкалы не являются научно обоснованными.
- 20. Абсолютная шкала температур Задание 6 Переведите в абсолютную шкалу температур: 27°C, - 97°C. Термодинамическая шкала температур
- 21. Тема 3. Основное уравнение МКТ
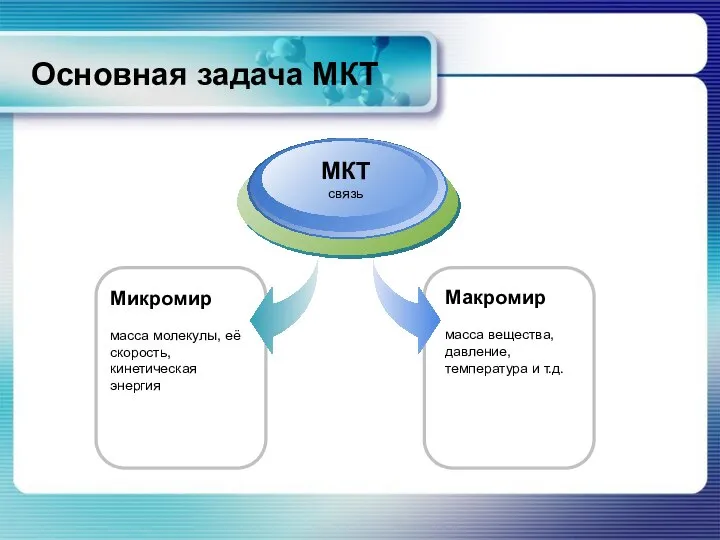
- 22. Основная задача МКТ Микромир масса молекулы, её скорость, кинетическая энергия МКТ связь Макромир масса вещества, давление,
- 23. Основное уравнение МКТ МКТ рассматривает давление газа на стенки сосуда, в котором он находится, как результат
- 24. Следствие Основное уравнение МКТ: Средняя кинетическая энергия молекулы газа: Давление газа равно 2/3 от средней кинетической
- 25. Закрепление Задание 7 Средняя кинетическая энергия поступательного движения молекул водорода равна 1,35⋅10-20Дж. Определите среднюю квадратичную скорость
- 26. Тема 4. Газовые законы
- 27. Изопроцессы Всякое изменение состояния газа называется термодинамическим процессом. Процесс, при котором один из параметров остается постоянным,
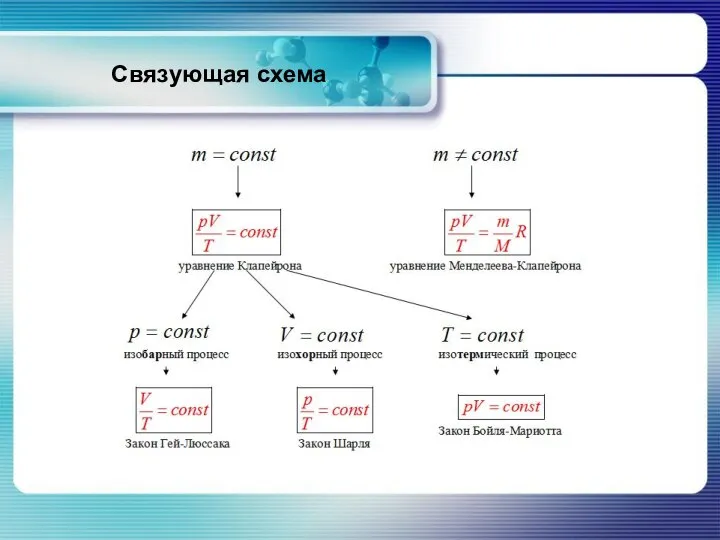
- 28. Изобарный процесс (p=const) Закон Гей-Люссака: при изобарном процессе отношение объёма данной массы газа к его абсолютной
- 29. Изохорный процесс (V=const) Закон Шарля: при изохорном процессе отношение давления данной массы газа к его абсолютной
- 30. Изотермический процесс (T=const) Закон Бойля - Мариотта: при изотермическом процессе произведение давления данной массы газа на
- 31. Уравнение Клапейрона На практике чаще всего встречаются случаи, когда одновременно изменяются все три параметра состояния. Можно
- 32. Уравнение Менделеева-Клапейрона В общем случае выполняется закон Менделеева-Клапейрона:
- 33. Связующая схема
- 34. Закрепление Задание 10 Каким должен быть наименьший объём V баллона, чтобы он вмещал m = 6,4
- 35. Средняя квадратичная скорость молекул Из уравнения Менделеева - Клапейрона Из основного уравнения МКТ - средняя квадратичная
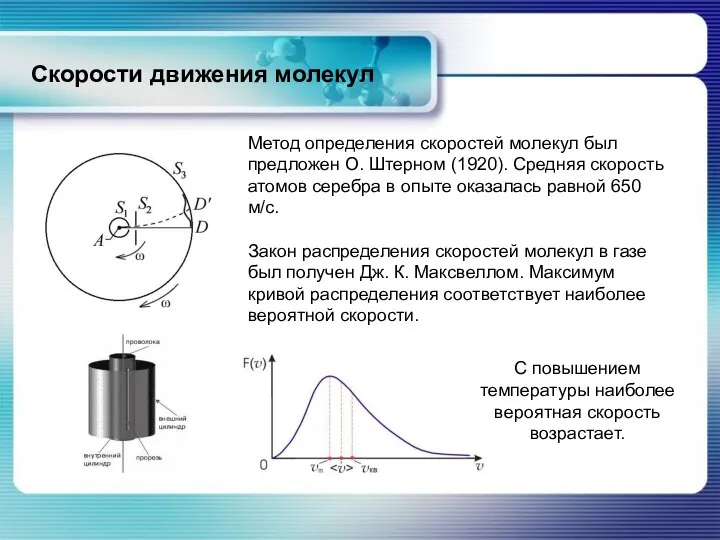
- 36. Скорости движения молекул Метод определения скоростей молекул был предложен О. Штерном (1920). Средняя скорость атомов серебра
- 37. Закрепление Задание 12 Определите температуру воздуха в аудитории. С какой средней квадратичной скоростью движутся молекулы кислорода
- 38. Литература: Дмитриева В.Ф. Физика для профессий и специальностей технического профиля: учебник для образовательных учреждений сред. проф.
- 40. Скачать презентацию
































 Типы кристаллических решёток
Типы кристаллических решёток Таблица Менделеева
Таблица Менделеева Химическая идентификация основных классов биомолекул
Химическая идентификация основных классов биомолекул Соль - без вины виновата
Соль - без вины виновата Вязкоупругие свойства полимеров
Вязкоупругие свойства полимеров Ориентация полимеров
Ориентация полимеров Массовая доля вещества в растворе
Массовая доля вещества в растворе Очистка хозяйственных и сточных вод от азота аммонийного с помощью нитрифицирующих бактерий
Очистка хозяйственных и сточных вод от азота аммонийного с помощью нитрифицирующих бактерий Выберите вещества
Выберите вещества Основы квантовой химии
Основы квантовой химии Теория электролитической диссоциации
Теория электролитической диссоциации Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Химическая картина мира
Химическая картина мира Презентация на тему Величие гениального творчества великого соотечественника
Презентация на тему Величие гениального творчества великого соотечественника  Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга
Измеритель концентрации асфальтенов в нефти с погружной решёткой Брэгга Закон сохранения массы и энергии
Закон сохранения массы и энергии Презентация на тему Альдегиды (10 класс)
Презентация на тему Альдегиды (10 класс)  Основные положения о строении вещества
Основные положения о строении вещества Круговорот серы в природе
Круговорот серы в природе Лекция 26. Химическое (водородное) и электрохимическое аккумулирование энергии
Лекция 26. Химическое (водородное) и электрохимическое аккумулирование энергии Презентация на тему Химический элемент - водород
Презентация на тему Химический элемент - водород  Химическая связь и строение молекул
Химическая связь и строение молекул Sinteticheskie_Materialy_I_Ikh_Rol_1
Sinteticheskie_Materialy_I_Ikh_Rol_1 Свойства солей, оксидов, оснований
Свойства солей, оксидов, оснований Бензол (Арены )
Бензол (Арены ) Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Волокна
Волокна Задача №8: Не тормози. Команда: Карбораны
Задача №8: Не тормози. Команда: Карбораны