Содержание
- 2. Содержание
- 3. СПИРТЫ R (OH)n Спиртами называются производные УВ, в которых один или несколько атомов водорода замещены на
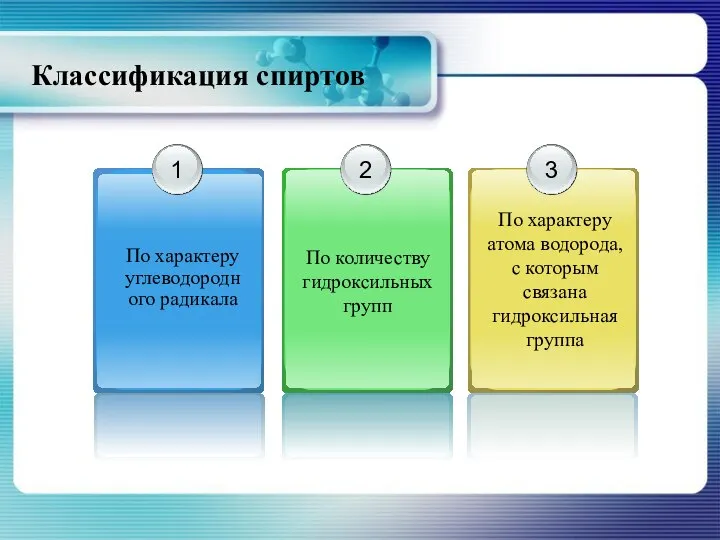
- 4. Классификация спиртов
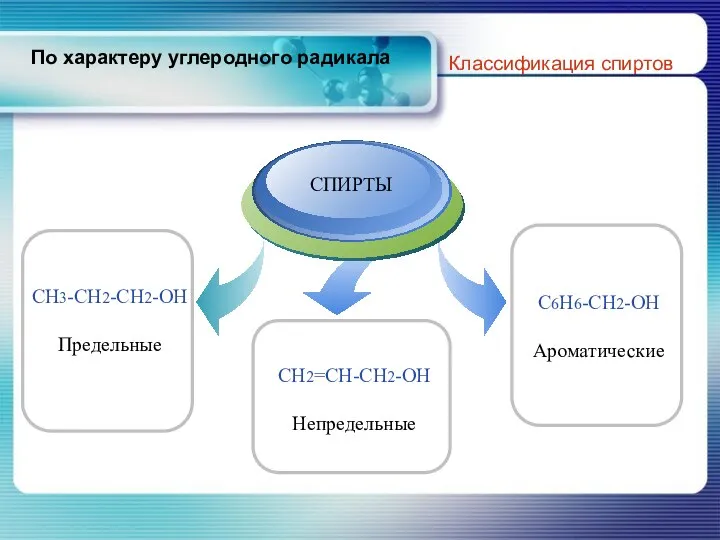
- 5. По характеру углеродного радикала Классификация спиртов
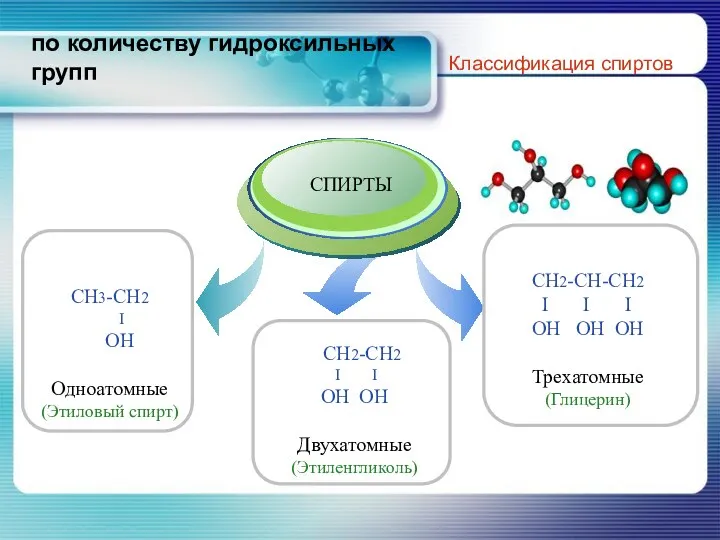
- 6. по количеству гидроксильных групп Классификация спиртов
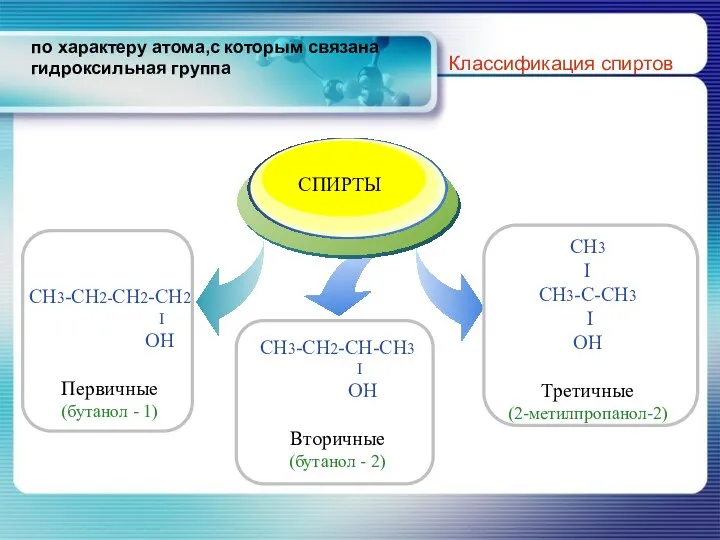
- 7. по характеру атома,с которым связана гидроксильная группа Классификация спиртов
- 8. Предельные одноатомные спирты Алканолы образуют гомологический ряд общей формулы CnH2n+1OH (n=1,2,3,…). Названия алканолов по систематичес-кой номенклатуре
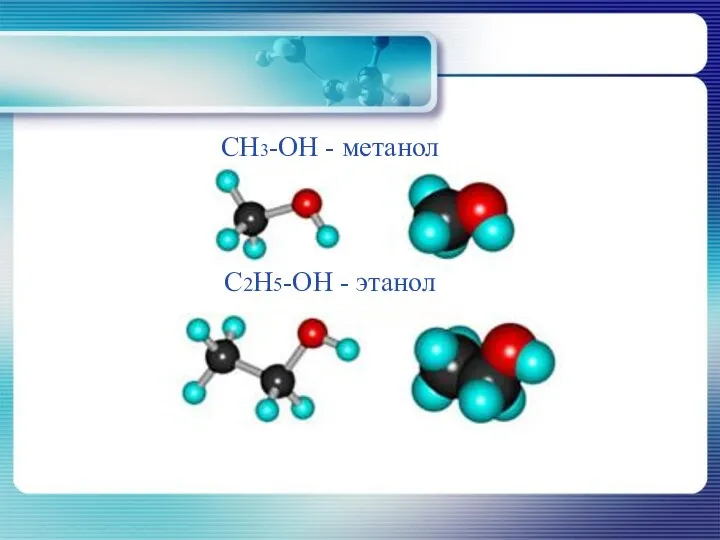
- 9. CH3-OH - метанол C2H5-OH - этанол
- 10. www.themegallery.com
- 11. Изомерия положения гидроксильной группы в углеродной цепи (с С3) CH3-CH2-CH2-OH пропанол-1 (пропиловый спирт) CH3-CH-CH3 l OH
- 12. CH3-CH2-CH2-CH2-OH бутанол-1 (бутиловый спирт) CH3-CH-CH2-OH l CH3 2-метилпропанол-1 (изобутиловый спирт) Первым из спиртов, для которого характерны
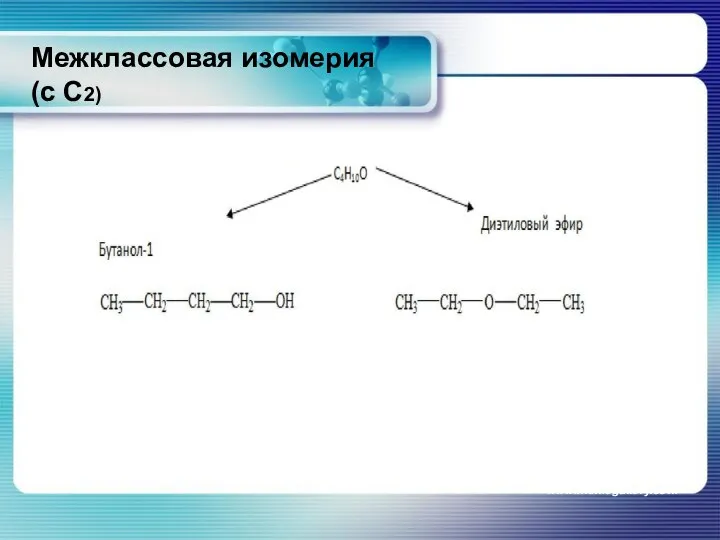
- 13. Межклассовая изомерия (с С2) www.themegallery.com
- 14. Физические свойства спиртов Алканолы являются бесцветными жидкостями или кристаллическими веществами с характерным запахом. Первые члены гомологического
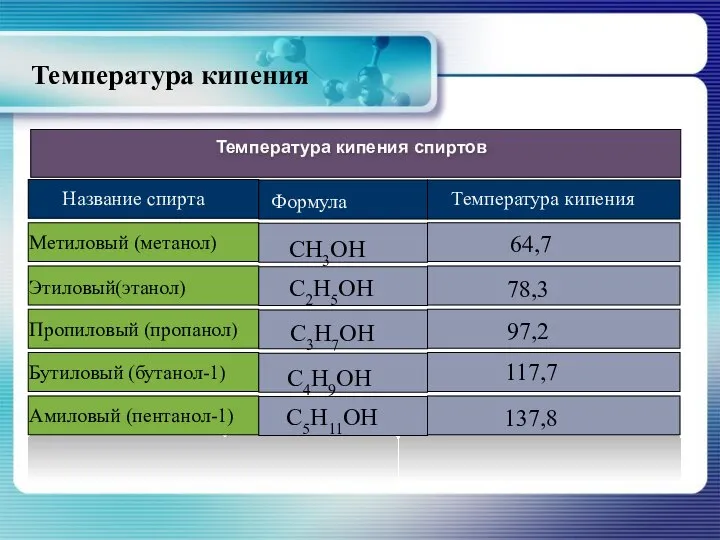
- 15. Температура кипения
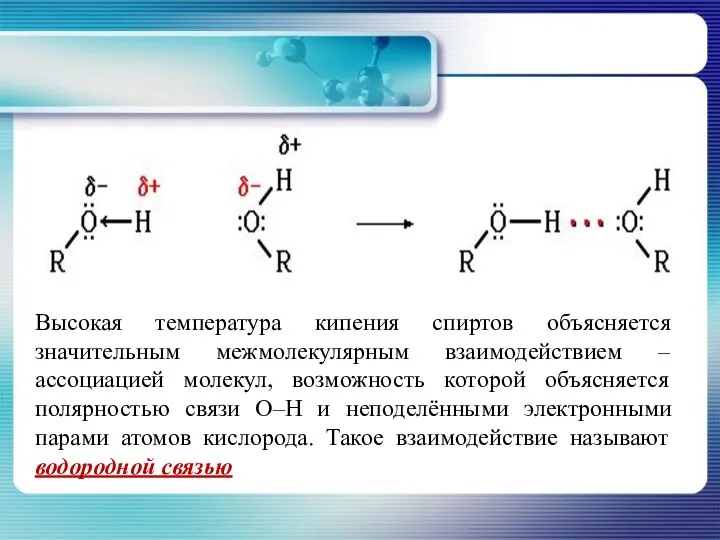
- 16. Высокая температура кипения спиртов объясняется значительным межмолекулярным взаимодействием – ассоциацией молекул, возможность которой объясняется полярностью связи
- 17. Строение молекулы этанола В молекуле этанола атомы углерода, водорода и кислорода связаны только одинарными - связями.
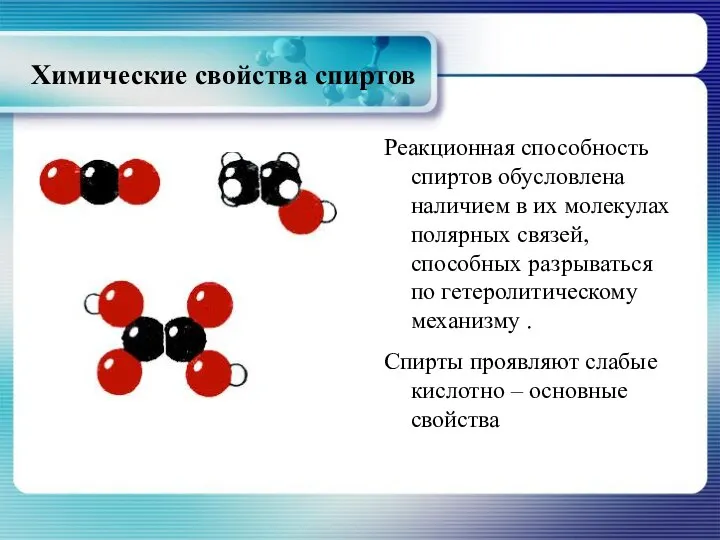
- 18. Химические свойства спиртов Реакционная способность спиртов обусловлена наличием в их молекулах полярных связей, способных разрываться по
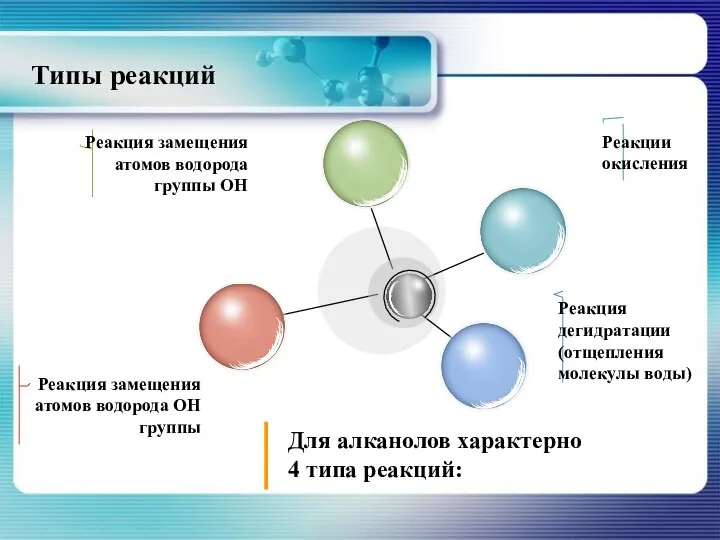
- 19. Типы реакций
- 20. Реакция замещения водорода -ОН группы 2С2Н5ОН + 2Na → 2C2H5ONa + H2 этилат Na Как слабые
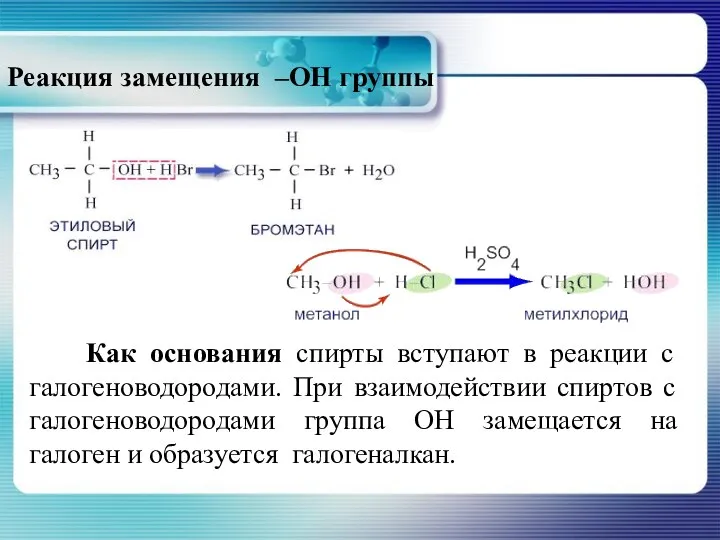
- 21. Реакция замещения –ОН группы Как основания спирты вступают в реакции с галогеноводородами. При взаимодействии спиртов с
- 22. Многоатомные спирты также, как и одноатомные спирты, реагируют с галогеноводородами. www.themegallery.com
- 23. Качественная реакция на многоатомные спирты Многоатомные спирты взаимодействуют с раствором гидроксида меди (II) в присутствии щелочи,
- 24. Реакция замещения –ОН группы Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на
- 25. Реакция дегидратации Для алканолов характерно два типа реакции дегидратации: - внутримолекулярная и - межмолекулярная При внутримолекулярной
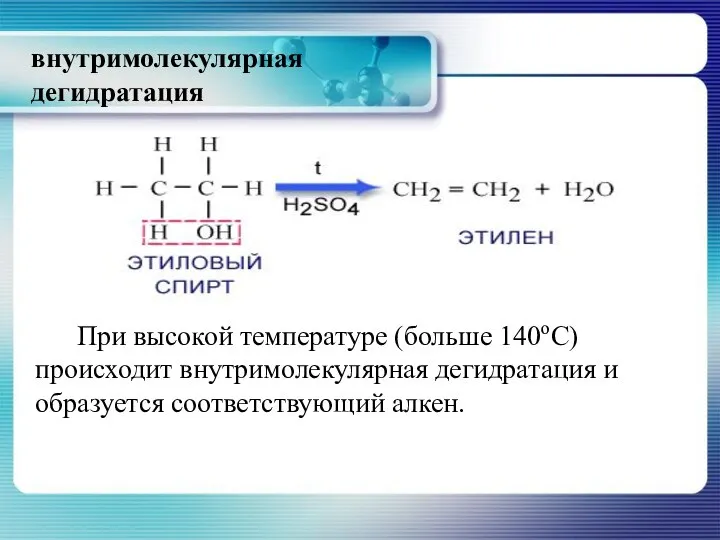
- 26. внутримолекулярная дегидратация При высокой температуре (больше 140оС) происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
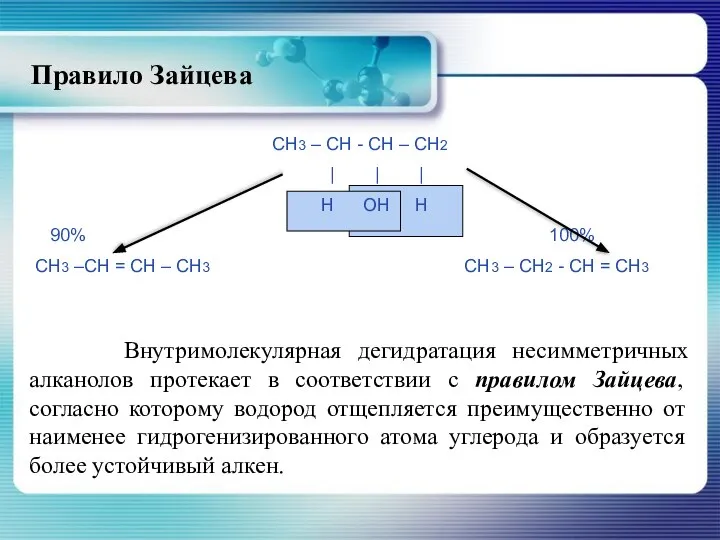
- 27. Правило Зайцева Внутримолекулярная дегидратация несимметричных алканолов протекает в соответствии с правилом Зайцева, согласно которому водород отщепляется
- 28. межмолекулярная дегидратация При низкой температуре (меньше 140оС) происходит межмолекулярная дегидратация. ОН-группа в одной молекуле спирта замещается
- 29. Дегидрирование спиртов При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола и
- 30. Этерификация (образование сложных эфиров) Одноатомные и многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные
- 31. Реакции окисления Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого
- 33. ПОЛУЧЕНИЕ Метанол и этанол Метанол получают гидрированием оксида углерода (II) СО. В настоящее время разработан способ
- 34. Спиртовое брожение глюкозы . C6H12O6
- 35. Мировое производство метанола составляет около 10 миллионов тонн в год, этанола производится примерно на порядок больше.
- 37. Скачать презентацию





















 Металлы. Химия. 11 класс
Металлы. Химия. 11 класс Классификация и номенклатура аминов. 11 класс
Классификация и номенклатура аминов. 11 класс Презентация на тему Химические свойства кислот
Презентация на тему Химические свойства кислот  Окислительно=восстановительное титрование
Окислительно=восстановительное титрование Презентация на тему Типы реакций
Презентация на тему Типы реакций  Метод Гиллеспи–Найхолма
Метод Гиллеспи–Найхолма Презентация на тему Радиация и её воздействие на человека
Презентация на тему Радиация и её воздействие на человека  Карбоновые кислоты
Карбоновые кислоты Презентация на тему Дисперсные системы
Презентация на тему Дисперсные системы  Презентация на тему Что такое нано?
Презентация на тему Что такое нано?  Свойства Н2
Свойства Н2 Электронное и пространственное строение алкенов. Гомология и изомерия алкенов
Электронное и пространственное строение алкенов. Гомология и изомерия алкенов 691614
691614 Вычисление массовой доли элемента в молекуле
Вычисление массовой доли элемента в молекуле Классификация_органических_соединений[1]
Классификация_органических_соединений[1] Классификация неорганических веществ
Классификация неорганических веществ Презентация на тему Хлороводород. Соляная кислота
Презентация на тему Хлороводород. Соляная кислота  Классификация органических соединений
Классификация органических соединений Презентация на тему Артур Конан-Дойл «Собака Баскервилей»
Презентация на тему Артур Конан-Дойл «Собака Баскервилей»  Презентация на тему Предельные одноатомные спирты
Презентация на тему Предельные одноатомные спирты  Алкены. Строение, номенклатура, изомерия
Алкены. Строение, номенклатура, изомерия Химическая связь
Химическая связь Получение, свойства и применение алкенов
Получение, свойства и применение алкенов Степень окисления. Бинарные соединения
Степень окисления. Бинарные соединения Неметаллы. Контрольная работа. 9 класс
Неметаллы. Контрольная работа. 9 класс Презентация лек №2
Презентация лек №2 Новогодний Пробник №190415
Новогодний Пробник №190415 Вещество и тело. Чистые вещества и смеси
Вещество и тело. Чистые вещества и смеси