Содержание
- 2. ПРЕДМЕТ БИООРГАНИЧЕСКОЙ ХИМИИ БИООРГАНИЧЕСКАЯ ХИМИЯ ИЗУЧАЕТ СТРОЕНИЕ, СВОЙСТВА, ПРЕВРАЩЕНИЯ, БИОЛОГИЧЕСКИЕ ФУНКЦИИ И ПРИМЕНЕ-НИЕ БИООРГАНИЧЕСКИХ СОЕДИНЕНИЙ БИООРГАНИЧЕСКИЕ
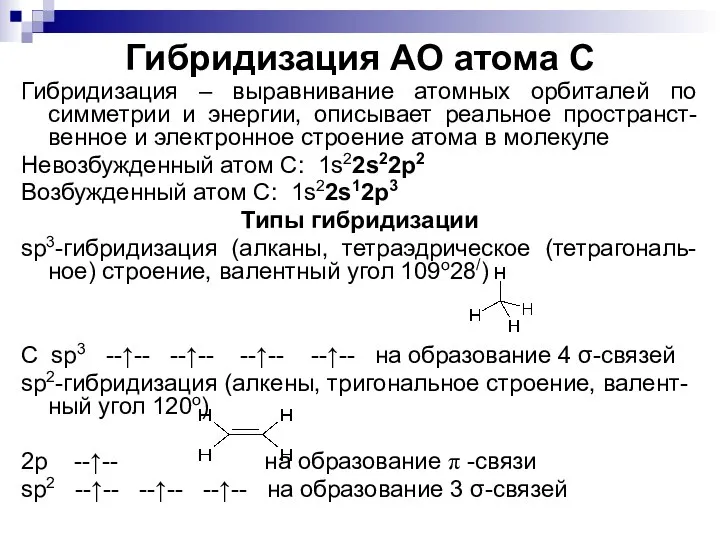
- 3. Гибридизация АО атома С Гибридизация – выравнивание атомных орбиталей по симметрии и энергии, описывает реальное пространст-венное
- 4. Сопряжение. Сопряженные системы Сопряженные системы – молекулы (или их фрагменты) определенного строения, обладающие характерным комплексом физико-химических
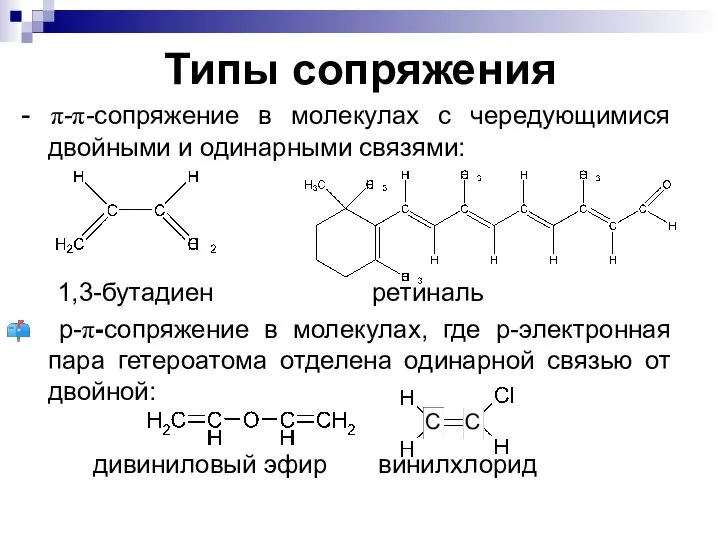
- 5. Типы сопряжения - π-π-сопряжение в молекулах с чередующимися двойными и одинарными связями: 1,3-бутадиен ретиналь р-π-сопряжение в
- 6. Ароматичность. Ароматические соединения Ароматические соединения – циклические сопряженные молекулы, подчиняющиеся критериям ароматичности и обладающие характерным комплексом
- 7. Критерии ароматичности - циклическая сопряженная система без разрывов сопряжения; - плоский цикл; число π - и
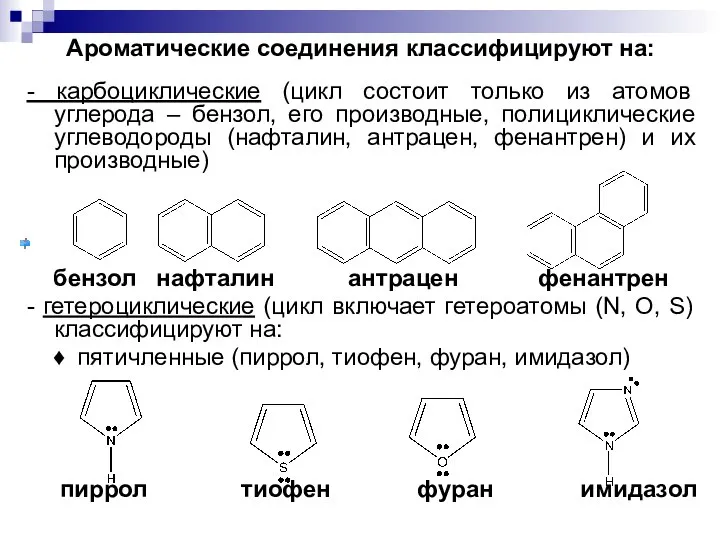
- 8. Ароматические соединения классифицируют на: - карбоциклические (цикл состоит только из атомов углерода – бензол, его производные,
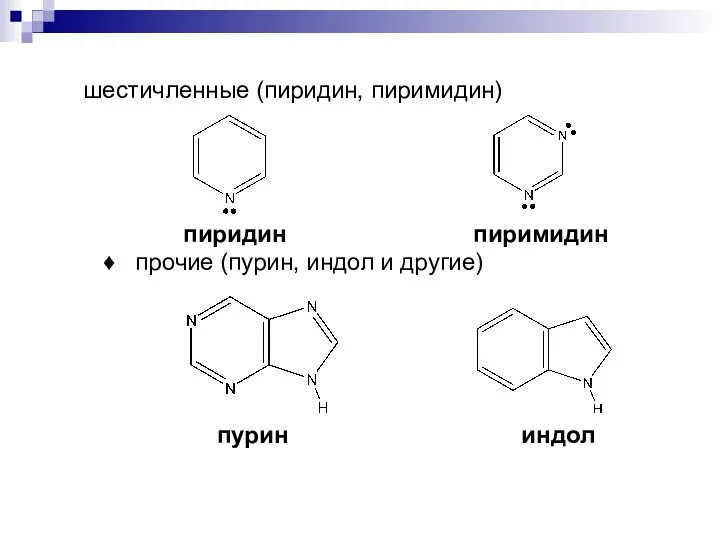
- 9. шестичленные (пиридин, пиримидин) пиридин пиримидин ♦ прочие (пурин, индол и другие) пурин индол
- 10. Ряды по ароматичности - бензол > нафталин > фенантрен > антрацен - бензол > тиофен >
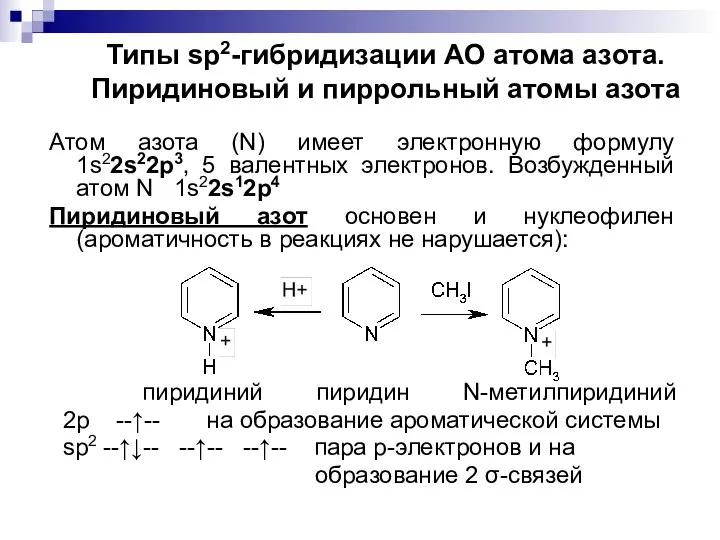
- 11. Типы sp2-гибридизации АО атома азота. Пиридиновый и пиррольный атомы азота Атом азота (N) имеет электронную формулу
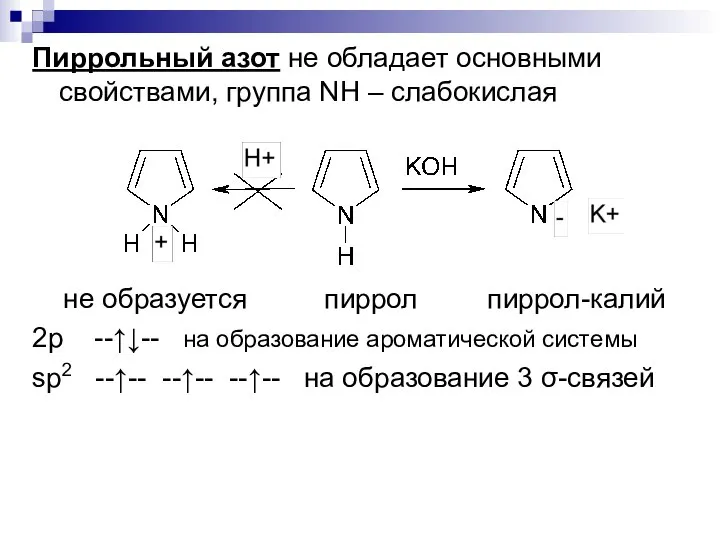
- 12. Пиррольный азот не обладает основными свойствами, группа NH – слабокислая не образуется пиррол пиррол-калий 2p --↑↓--
- 13. Биозначение сопряженных и ароматических соединений 1 Сопряженные и ароматические молекулы широко представлены в живых клетках
- 14. Биозначение сопряженных и ароматических соединений 2 кофермент гем и метаболит билирубин – производные пиррола; азотистые основания
- 15. ЭЛЕКТРОННЫЕ ЭФФЕКТЫ В ОРГАНИЧЕСКИХ МОЛЕКУЛАХ Электронные эффекты – перераспределение электронов химических связей и разделение зарядов между
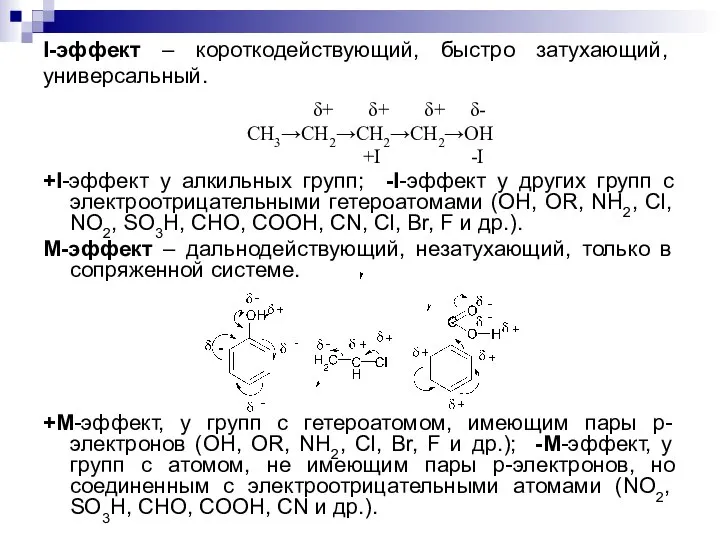
- 16. I-эффект – короткодействующий, быстро затухающий, универсальный. δ+ δ+ δ+ δ- CH3→CH2→CH2→CH2→OH +I -I +I-эффект у алкильных
- 17. КИСЛОТНОСТЬ – ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Кислота (по Брёнстеду) – химическое соединение, отщепляющее протон: R-A-H R-Ä- +
- 18. ПРОТОЛИТИЧЕСКАЯ ТЕОРИЯ СОПРЯЖЕННЫХ КИСЛОТ И ОСНОВАНИЙ БРЁНСТЕДА – ЛОУРИ. ОСНОВНЫЕ ПОЛОЖЕНИЯ 1. Если в системе имеется
- 19. ФАКТОРЫ, ВЛИЯЮЩИЕ НА КИСЛОТНОСТЬ И ОСНОВНОСТЬ ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ Кислота R-A-H R-Ä- + H+ Основание R-B: +
- 20. Кислота R-A-H R-Ä- + H+ Основание R-B: + H+ R-B+-H 3. Природа заместителя R Электроноакцепторные заместители
- 22. Скачать презентацию












 user_file_562b6f7f7ae4e
user_file_562b6f7f7ae4e Методы выделения и разделения радионуклидов
Методы выделения и разделения радионуклидов Основы химии буровых растворов
Основы химии буровых растворов Углерод. 9 класс
Углерод. 9 класс Биоорганическая химия
Биоорганическая химия Дисперсные системы
Дисперсные системы Получение и применение аренов
Получение и применение аренов Техника безопасности при использовании различных видов топлива. Практическая работа № 3
Техника безопасности при использовании различных видов топлива. Практическая работа № 3 Карбонаты. Лекция 12
Карбонаты. Лекция 12 Карбон
Карбон lll-l группы главные подгруппы. 11 класс
lll-l группы главные подгруппы. 11 класс Алкены. Пентен- С5Н10
Алкены. Пентен- С5Н10 Классы неорганических веществ
Классы неорганических веществ Практические задания по химии
Практические задания по химии Тренажер. Типы химических реакций
Тренажер. Типы химических реакций Шуточные загадки Периодической системы химических элементов
Шуточные загадки Периодической системы химических элементов Кинетика кристаллизации сплавов
Кинетика кристаллизации сплавов Карбоновые кислоты, их строение, номенклатура, получение и свойства
Карбоновые кислоты, их строение, номенклатура, получение и свойства Ионные уравнения
Ионные уравнения Презентация на тему Применение спиртов
Презентация на тему Применение спиртов  Презентация Щелочные металлы
Презентация Щелочные металлы Кислоты
Кислоты Обобщение темы Органические вещества. Классификация органических веществ по углеродному скелету
Обобщение темы Органические вещества. Классификация органических веществ по углеродному скелету Неорганические вещества клетки для дистанта (2)
Неорганические вещества клетки для дистанта (2) Гравиметрический анализ (ГА) - метод количественного химического анализа, основанный на точном измерении массы определяемого
Гравиметрический анализ (ГА) - метод количественного химического анализа, основанный на точном измерении массы определяемого Её величество – вода Интегрированный урок химии в 8 классе
Её величество – вода Интегрированный урок химии в 8 классе prezentatsia_lektsia_1_LF_Rastvory_Kolligativnye_svoi_774_stva_rastvorov_Osmos
prezentatsia_lektsia_1_LF_Rastvory_Kolligativnye_svoi_774_stva_rastvorov_Osmos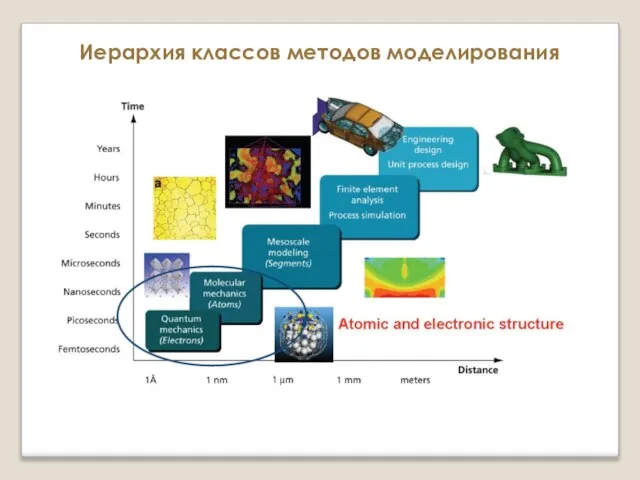 Атомистическое моделирование
Атомистическое моделирование