Содержание
- 2. Познакомиться с азотной кислотами, её солями- нитратами, их физическими и химическими свойствами ; Экспериментально изучить свойства
- 3. Когда - то селитрами звали нитраты, а "духом" была кислота
- 4. Бесцветная жидкость «Дымится» на воздухе Едкая Плотность в 1,4 раза больше плотности воды На свету желтеет
- 5. Разложение 4HNO3=4NO2+2H2O+O2
- 7. +5 +4 N +1e=N +5 +2 N +3е= N +5 -3 N +8e =N
- 8. Взаимодействие с металлами 3Cu+8HNO3=3Cu(NO3)2+2NO +4H 2O 0 +2 Cu -2e=Cu +5 +2 N + 3e =N
- 9. Ag+2HNO 3=AgNO 3+NO 2 +H 2O 0 + Ag -1e=Ag +5 +4 N +1e=N
- 10. 4Zn+10HNO 3=4Zn(NO 3) 2+NH 4NO3 +3H 2O 0 +2 Zn -2e=Zn +5 -3 N +8e=N
- 11. 2KNO 3=2KNO 2+O 2 2Cu(NO 3) 2=2CuO+4NO 2 +O 2 2AgNO3=2Ag+2NO 2 + O 2 Нитраты.Разложение
- 12. NH 4NO3 =2H 2 O+N 2O NH 4NO 2=2H 2O+N2
- 13. Применение азотной кислоты и нитратов
- 14. Красители
- 15. Удобрения
- 16. Взрывчатка
- 17. Лекарства
- 18. Пластмассы
- 19. Искусственные волокна
- 20. 20 Проверь сам себя
- 21. Параграф №26,стр.119 – 12 рабочая тетрадь,стр.№ Домашнее задание
- 22. Спасибо за урок
- 24. Скачать презентацию










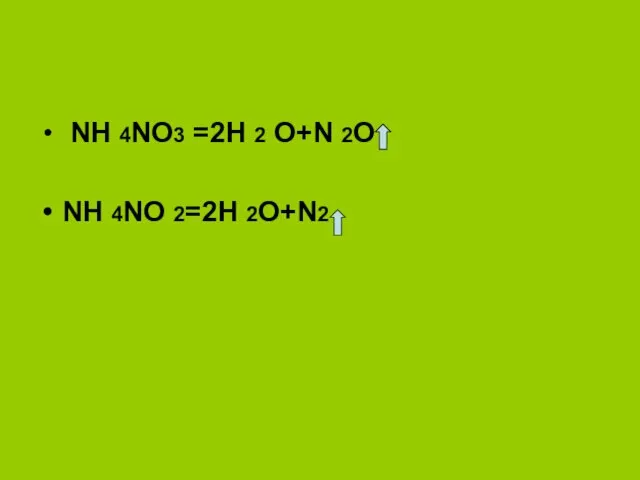









 Химические реакции
Химические реакции Классы неорганических соединений
Классы неорганических соединений Кристаллогидраты
Кристаллогидраты Конкурс юных химиков
Конкурс юных химиков Материаловедение. Строение металлических материалов. Металлические сплавы
Материаловедение. Строение металлических материалов. Металлические сплавы Электрический ток в металлах
Электрический ток в металлах Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение
Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение Ķīmiskais līdzsvars un faktori, kas to ietekmē
Ķīmiskais līdzsvars un faktori, kas to ietekmē Неметаллы в природе и жизни человека
Неметаллы в природе и жизни человека Презентация на тему Удобрения и их классификация
Презентация на тему Удобрения и их классификация  Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами
Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами Амины. Классификация аминов
Амины. Классификация аминов Коррозия металлов и борьба с ней. Лабораторная работа
Коррозия металлов и борьба с ней. Лабораторная работа Dereglarea metabolismului
Dereglarea metabolismului Презентация на тему Обратимость химических реакций. Химическое равновесие
Презентация на тему Обратимость химических реакций. Химическое равновесие  Соль и ее свойства. Добыча соли
Соль и ее свойства. Добыча соли Кислоты. состав, номенклатура и их их классификация
Кислоты. состав, номенклатура и их их классификация Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества
Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества Свойства воды
Свойства воды Протравка стекла с помощью ионного обмена
Протравка стекла с помощью ионного обмена Интеллектуальная игра по химии Металлы
Интеллектуальная игра по химии Металлы Витамины. (10 класс)
Витамины. (10 класс) Состав и свойства нефти
Состав и свойства нефти Соединения железа в природе
Соединения железа в природе 9 кл Урок 7 Розчинність речовин
9 кл Урок 7 Розчинність речовин Химическая связь и строение вещества
Химическая связь и строение вещества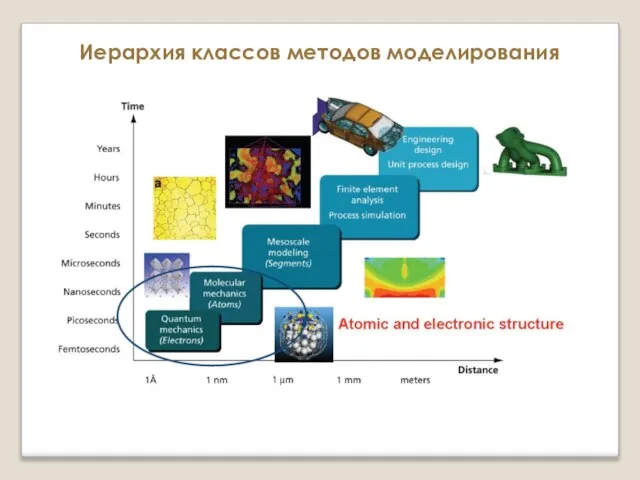 Атомистическое моделирование
Атомистическое моделирование Физическая химия
Физическая химия