Содержание
- 2. Определение: Скорость химической реакции – это изменение количества реагирующего вещества в единицу времени в единице объёма.
- 3. Пояснение: Иными словами, скорость реакции – это изменение концентрации одного из реагирующих веществ в единицу времени.
- 4. Скорость реакции, факторы: Фактор внутренних химических связей: Природа реагирующих веществ (прочность химических связей в веществе) def
- 5. Скорость реакции, факторы: Фактор температуры (энергии активации): def : Энергия активации – энергия промежуточного состояния, выше
- 6. Скорость реакции, факторы: Правило Вант-Гоффа: Здесь rТ2 и rТ1 – скорости реакции соответственно при температурах T2
- 7. Скорость реакции, факторы: Фактор Катализатора: def : Катализатор – промежуточный реагент, понижающий энергию активации химической реакции,
- 8. Скорость реакции, факторы: Фактор Ингибитора: def : Ингибитор — вещество, замедляющие или предотвращающие течение различных химических
- 9. Скорость реакции, факторы: Фактор Концентрации (Закон действующих масс) def : Закон действующих масс устанавливает соотношение между
- 10. Скорость реакции, факторы: Фактор Концентрации (Закон действующих масс) def : Константа равновесия – постоянная величина, полученная
- 12. Скачать презентацию









 Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Сравнение свойств неорганических и органических веществ
Сравнение свойств неорганических и органических веществ Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів
Жири. Склад жирів, фізичні властивості. Природні й гідрогенізовані жири. Біологічна роль жирів Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6
Изучение зависимости скорости химической реакции от различных факторов. Практическая работа № 6 Эмпирические правила
Эмпирические правила Получение галогеноалканов
Получение галогеноалканов Алканы 10-класс
Алканы 10-класс Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Понятие о спиртах
Понятие о спиртах Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1
Оптические свойства ювелирных камней. Цвет плеохроизм. Часть 1 Классификация неорганических соединений
Классификация неорганических соединений Химические уравнения
Химические уравнения Водород. Вода
Водород. Вода Атомы химических элементов
Атомы химических элементов Серная кислота. Свойства серной кислоты
Серная кислота. Свойства серной кислоты Приложения для отслеживания проб ALS Geochemistry
Приложения для отслеживания проб ALS Geochemistry Предмет органической химии
Предмет органической химии Презентация по Химии "Sulfur"
Презентация по Химии "Sulfur"  Классификация методов аналитической химии
Классификация методов аналитической химии Химическая связь
Химическая связь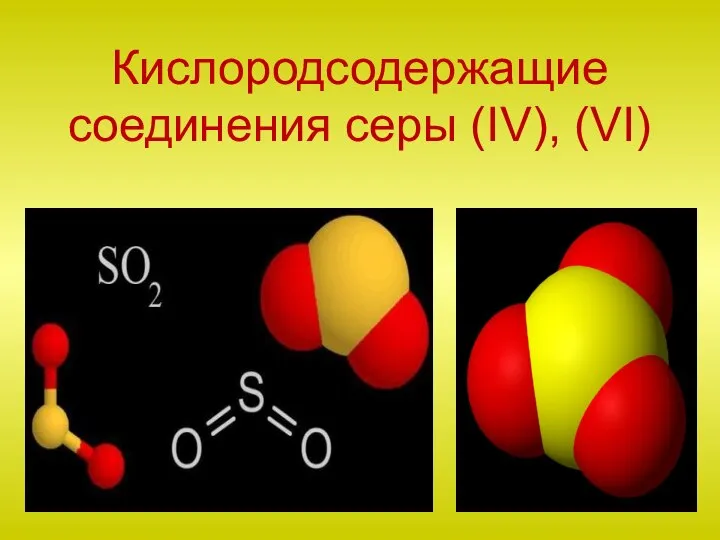 Кислородсодержащие соединения серы (IV), (VI)
Кислородсодержащие соединения серы (IV), (VI) Алкены
Алкены Поликарбонат мономерлері
Поликарбонат мономерлері Презентация на тему Химия в криминалистике
Презентация на тему Химия в криминалистике  Железо и его соединения
Железо и его соединения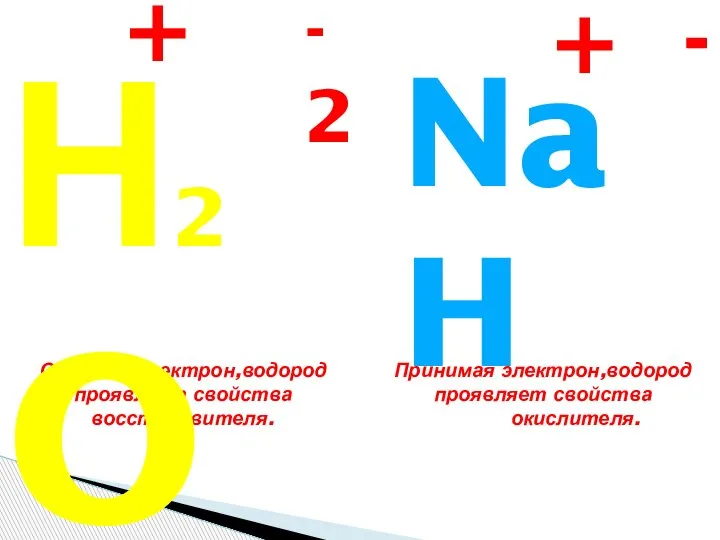 Кислород и водород
Кислород и водород Электролитическая диссоциация
Электролитическая диссоциация Метод валентных связей
Метод валентных связей