Содержание
- 2. Цели и задачи определить математические методы решения химических задач; научиться решать химические задачи математическим способом; показать
- 3. Введение Математическая химия — раздел теоретической химии, область исследований, посвящённая новым применениям математики к химическим задачам.
- 4. Среди задач по химии, предлагаемых учащимся на олимпиадах, а выпускникам на вступительных экзаменах встречаются такие расчетные
- 5. История Первая попытка по математизации химии была сделана М.В. Ломономовым. Его рукопись Elementa Chimiae Mathematicae («Элементы
- 6. Интересный факт Интересную связь математики и химии можно продемонстрировать на интересном примере формулы идеальной чашки чая:
- 7. Школьная химия отличается от школьной физики меньшим количеством формул. Несколько из них связаны с расчетами количества
- 8. Существует 3 формулы, связанные с расчетом массовой доли 1)Массовая : ω= mч/ m ( см) Где
- 9. К описанным формулам следует добавить уравнение, необходимое для расчета количества электричества: Q= I t Где I
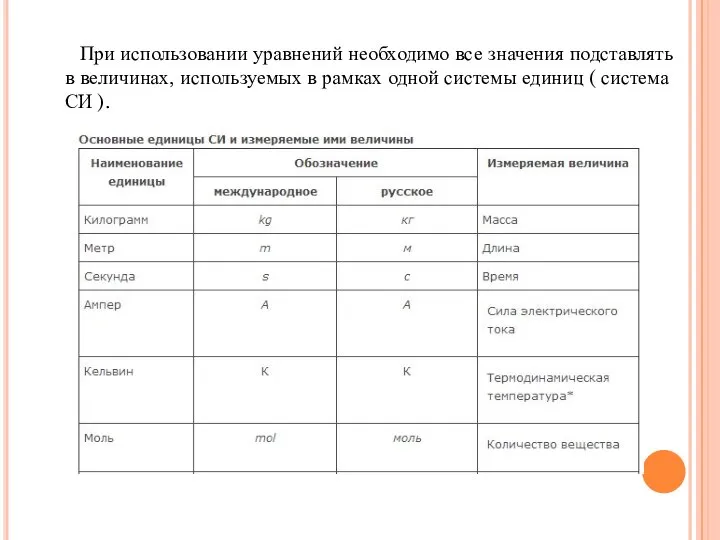
- 10. При использовании уравнений необходимо все значения подставлять в величинах, используемых в рамках одной системы единиц (
- 12. Метод двух неизвестных Задача №1. Определить формулу углеводорода, если его молярная масса равна 96.
- 13. Решение. Любой углеводород имеет общую формулу Сх Ну. Составим выражение для молярной массы данного углеводорода 12х+
- 14. Задача №2. Определите формулу соединения, если известно, что массовая доля металла составляет 28%, серы 24%, кислорода
- 15. Решение. Определим соотношение между серой и кислородом. В 100 г вещества n(S)= 24:32=0,75, а n(О)= 48:16=3.
- 16. Расчет состава смесей по уравнениям химических реакций Задача. В результате полного восстановления 30,4 г смеси монооксида
- 17. хг у1 1) FeO + CO ? Fe + CO2 1 Моль 1Моль (30,4 – x)Г
- 18. Метод вычитания масс Задача. Медную пластину опустили в раствор трихлорида золота. Через некоторое время ее вынули,
- 19. Решение. Наиболее простым способом решения данной задачи является метод вычитания масс: m( Cu) m (Au) 2AuCl3
- 20. Метод молекулярной формулы Молекулярная формула углеводорода заданного (известного) гомологического ряда однозначно определяется его относительной молекулярной массой.
- 21. Задача. При сгорании алкана массой 5 г образовалось 15,35 г углекислого газа и 7,33 г воды.
- 22. Решение. Этот способ решения задачи методом молекулярной формулы является наиболее легким и коротким. Найдем формулу алкана
- 23. Заключение При решении задач на уроках химии необходимы математические умения. К ним относятся использование и выведение
- 25. Скачать презентацию



















 Органическая химия. Классификация. Номенклатура
Органическая химия. Классификация. Номенклатура Номенклатура органических соединений. Упражнения
Номенклатура органических соединений. Упражнения Ковалентная полярная связь
Ковалентная полярная связь Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Физический этап развития периодического закона
Физический этап развития периодического закона a319f492a6071afff03d7efc722c906b
a319f492a6071afff03d7efc722c906b Первоначальные химические понятия
Первоначальные химические понятия Диеновые углеводороды. Алкадиены
Диеновые углеводороды. Алкадиены Алканы
Алканы Медь и ее сплавы
Медь и ее сплавы Классификация силикатов
Классификация силикатов День химии
День химии Аминокислоты. Пептиды. Белки. Тема 2
Аминокислоты. Пептиды. Белки. Тема 2 Металлы - наши друзья или враги
Металлы - наши друзья или враги Решение расчетных задач
Решение расчетных задач Теория электролитической диссоциации
Теория электролитической диссоциации Силумины. Виды силуминов
Силумины. Виды силуминов Пористые стекла
Пористые стекла Масс-спектрометрия шерсти волка обыкновенного Canis lupus
Масс-спектрометрия шерсти волка обыкновенного Canis lupus Звездный час по химии
Звездный час по химии Ионная полимеризация
Ионная полимеризация Повторение по теме Химические реакции
Повторение по теме Химические реакции Химия - неотъемлемая часть жизни
Химия - неотъемлемая часть жизни Мастер - класс: Окислительно-восстановительные реакции
Мастер - класс: Окислительно-восстановительные реакции Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты
Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты Получение и реакции пиразина
Получение и реакции пиразина Алюминий. Из истории открытия
Алюминий. Из истории открытия Бораны и карбораны
Бораны и карбораны