Содержание
- 2. СаСО3 = СаО + СО2 Химические реакции: - без изменения степени окисления: - С изменением степени
- 3. Степень окисления – это условный заряд атома элемента в соединении, вычисленный из предположения, что валентные электроны
- 4. Валентность характеризует способность атомов образовывать химические связи с атомами других элементов. Имеет всегда положительное значение и
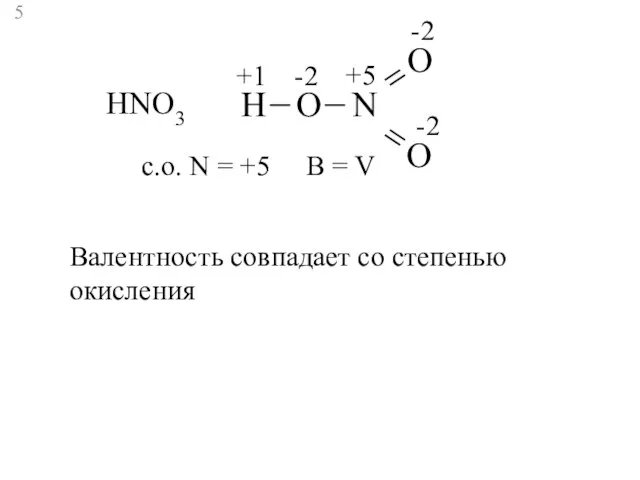
- 5. HNO3 H N O O O +1 -2 -2 -2 +5 c.о. N = +5 В
- 6. S H H O O O S +1 +1 -2 -2 -2 -2 +6 с.о. S
- 7. Постоянную степень окисления имеют: - атомы щелочных металлов +1; - атомы щелочноземельных металлов +2; водород +1;
- 8. Окисление: Cr+3 - 3e→ Cr+6; Al0 - 3e→ Al+3; Cl–- 6e→Cl+5 Окислением называется процесс отдачи электронов
- 9. Восстановление: Clo + 1e → Cl–; So + 2e→ S–2; No + 3e→ N–3 Восстановление –
- 10. Число электронов, отданных восстановителем, = числу электронов, принятых окислителем.
- 11. Основные окислители и восстановители Элементы в высших с.о. являются окислителями (могут только принимать электроны) H2SO4 +6
- 12. Элементы в низших с.о. являются восстановителями (могут только отдавать электроны) H2S -2 S 0 2s2 2p4
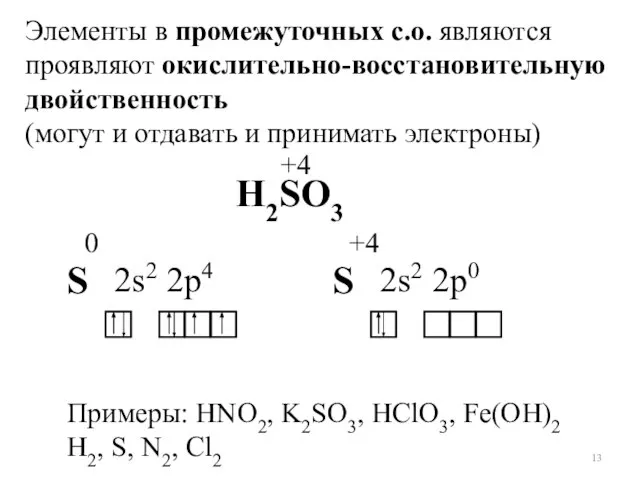
- 13. Элементы в промежуточных с.о. являются проявляют окислительно-восстановительную двойственность (могут и отдавать и принимать электроны) H2SО3 +4
- 14. Основные окислители и восстановители
- 15. Составление уравнений окислительно-восстановительных реакций Метод электронного баланса NaNO2+H2SO4+KMnO4→NaNO3+MnSO4+K2SO4+ H2O 1) определяют элементы, меняющие степень окисления в
- 16. 3) находят дополнительные множители и указывают характер процессов N+3 – 2 → N+5 5 восст-ль, ок-е
- 17. 5) остальные коэффициенты подбираются в последовательности: уравнивается число атомов металлов (кроме окислителя и восстановителя); - уравнивается
- 18. 5Na N+3O2 + 3H2SO4 + 2KMn+7O4 → 5NaN+5O3+ + 2Mn+2SO4 + K2SO4 + 3H2O 30 [O]
- 19. Типы ОВР 1) Межмолекулярная ОВР – реакция, в которой в качестве окислителя и восстановителя выступают частицы
- 20. 2) Реакция диспропорционирования (самоокисления-самовосстановления) – ОВР, в которой в качестве окисления и восстановления выступают атомы одного
- 21. 3) Внутримолекулярная ОВР – реакция, в которой в качестве окислителя и восстановителя выступают атомы разных элементов
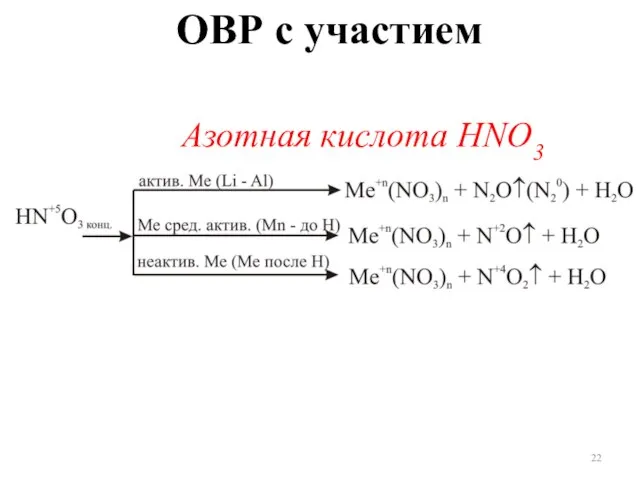
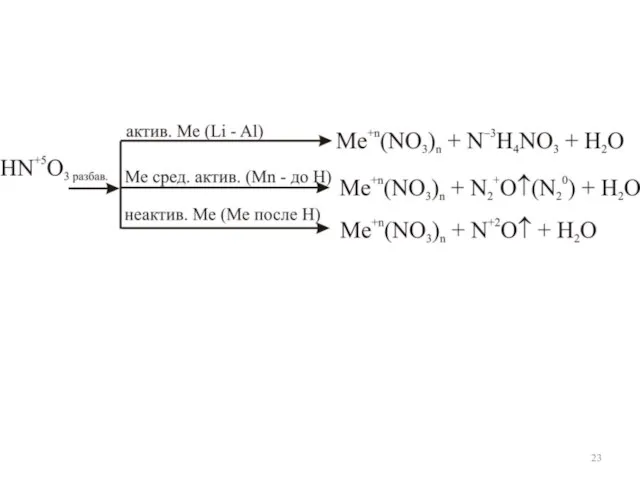
- 22. ОВР с участием Азотная кислота HNO3
- 24. Серная кислота H2SO4 Разбавленная серная кислота Mg + H2SO4 → MgSO4 + H2
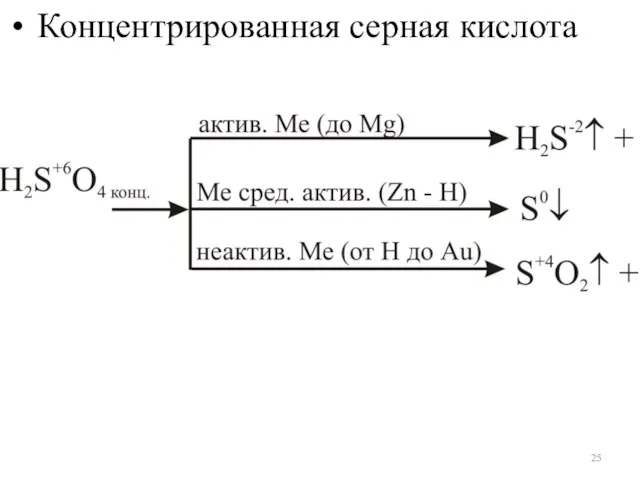
- 25. Концентрированная серная кислота
- 27. Скачать презентацию














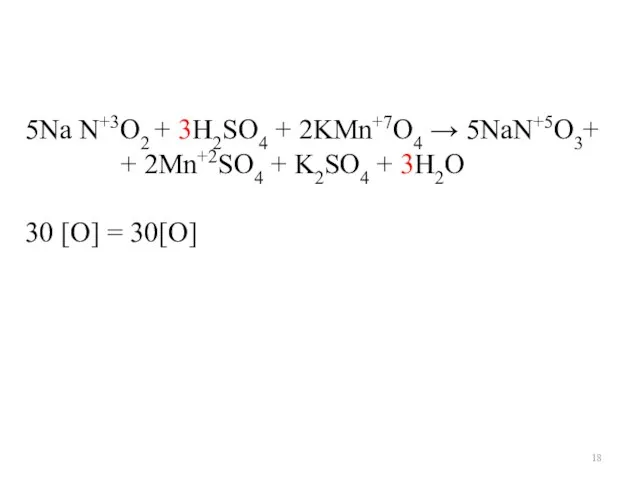




 Ниобий. Химические свойства
Ниобий. Химические свойства Презентация на тему Производство стекла
Презентация на тему Производство стекла  Презентация на тему СПИРТЫ (аканолы, алкоголи)
Презентация на тему СПИРТЫ (аканолы, алкоголи)  Ионные уравнения реакций
Ионные уравнения реакций Определение содержания иона цинка в фармацевтическом препарате гравиметрическим методом
Определение содержания иона цинка в фармацевтическом препарате гравиметрическим методом Физика полимеров Ч1
Физика полимеров Ч1 Классификация спиртов
Классификация спиртов Дисперсные системы
Дисперсные системы Классификация ХГ методов разделения
Классификация ХГ методов разделения Строение электронных оболочек атомов элементов
Строение электронных оболочек атомов элементов Химическое равновесие в растворах электролитов
Химическое равновесие в растворах электролитов Презентация на тему Водород (8 класс)
Презентация на тему Водород (8 класс)  Металдар мен қорытпалардың құрылысы және қасиеттері
Металдар мен қорытпалардың құрылысы және қасиеттері Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего Жидкое состояние вещества
Жидкое состояние вещества Вводный урок по химии
Вводный урок по химии Алкены
Алкены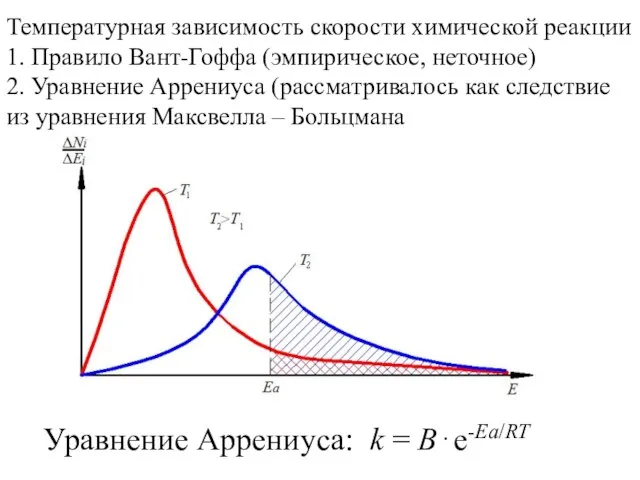 Температурная зависимость скорости химической реакции
Температурная зависимость скорости химической реакции Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Углеводороды
Углеводороды Природные и искусственные материалы. Естествознание 6 класс
Природные и искусственные материалы. Естествознание 6 класс Радиоактивность. Тест
Радиоактивность. Тест Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений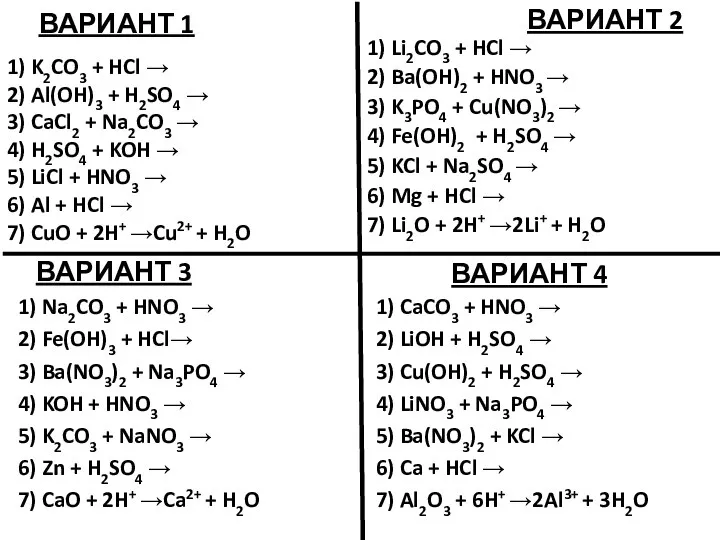 Уравнения возможных реакций. Задание
Уравнения возможных реакций. Задание Бикомпонентные покрытия
Бикомпонентные покрытия Галогениды, нитраты и сульфаты лантаноидов
Галогениды, нитраты и сульфаты лантаноидов Оксиды и гидроксиды металлов
Оксиды и гидроксиды металлов Вещество. Свойства вещества. Урок №2
Вещество. Свойства вещества. Урок №2