Содержание
- 2. Цель урока: Продолжить формирование понятия об атоме как сложной нейтральной частице, состоящей из протонов, нейтронов и
- 3. Задачи урока; Образовательные: Познакомить учащихся с моделями атома Томсона и Резерфорда Изучить планетарную модель атома, состав
- 4. Эпиграф к уроку «Отыщи всему начало и ты многое поймешь»
- 5. УРОК ХИМИИ В 8 КЛАССЕ ОСНОВНЫЕ СВЕДЕНИЯ О СТРОЕНИИ АТОМОВ
- 7. Демокрит В основе философии Демокрита лежит учение об атомах и пустоте как двух принципах, порождающих многообразие
- 8. Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, существующими в
- 9. Модель Томсона В 1904 году Томсон представил свою новую модель атома. Она представляла собой также равномерно
- 10. Расщепление радиоактивного излучения в электрическом поле
- 11. Опыт Резерфорда Резерфорд исследовал особенности прохождения альфа-частиц через тонкие металлические пластинки. На основании этих опытов ученый
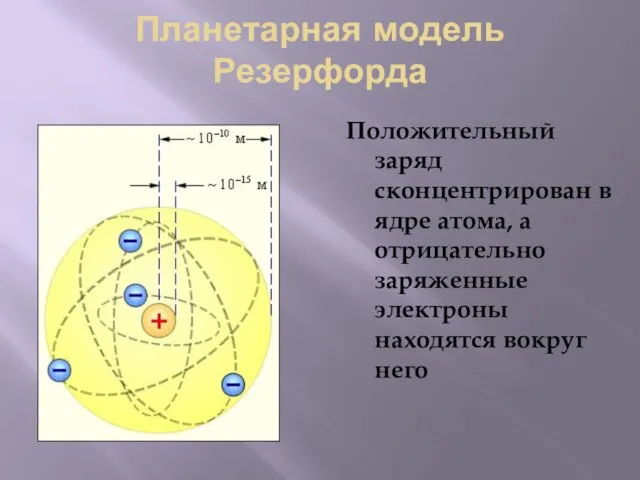
- 12. Планетарная модель Резерфорда Положительный заряд сконцентрирован в ядре атома, а отрицательно заряженные электроны находятся вокруг него
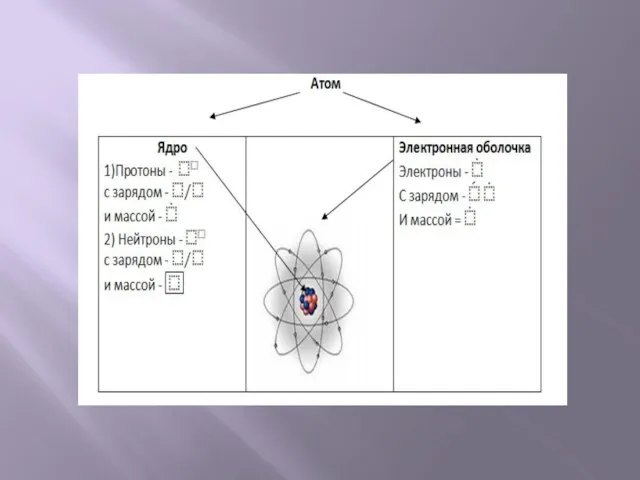
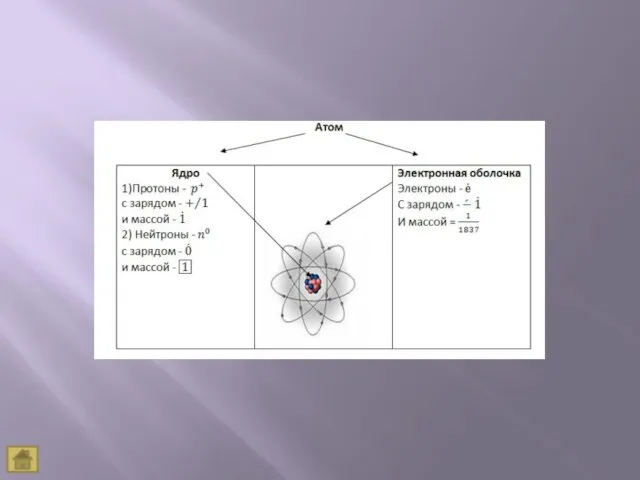
- 13. В атоме электроны вращаются вокруг атомного ядра, которое заряжено положительно и притягивает отрицательно заряженные электроны В
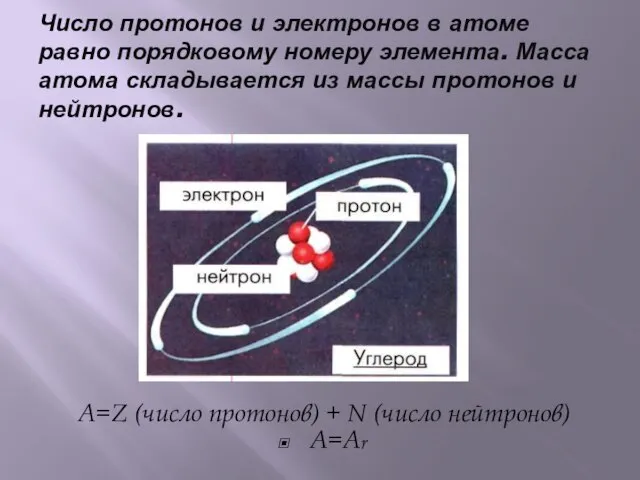
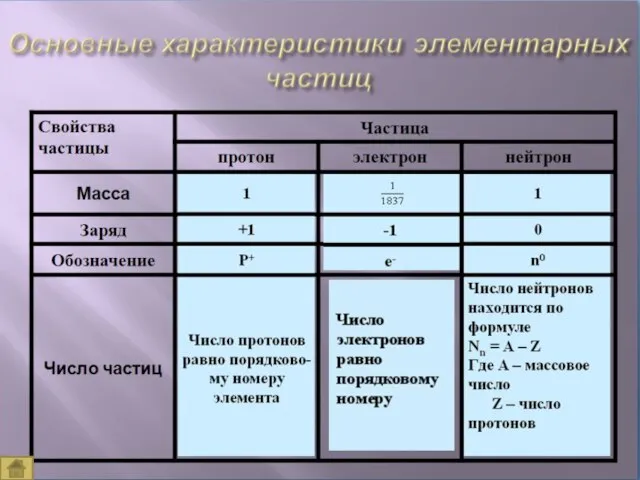
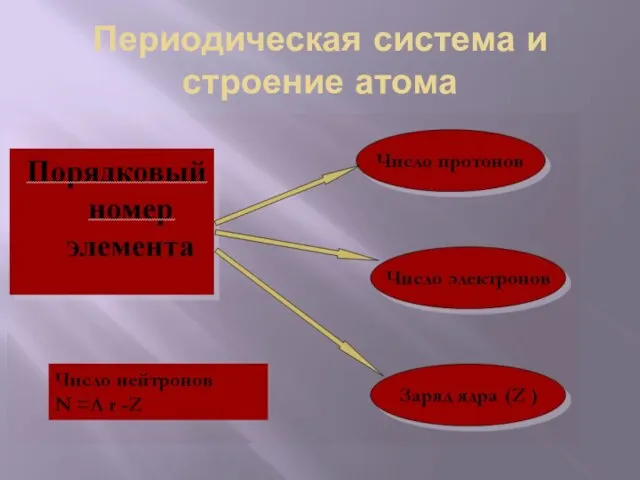
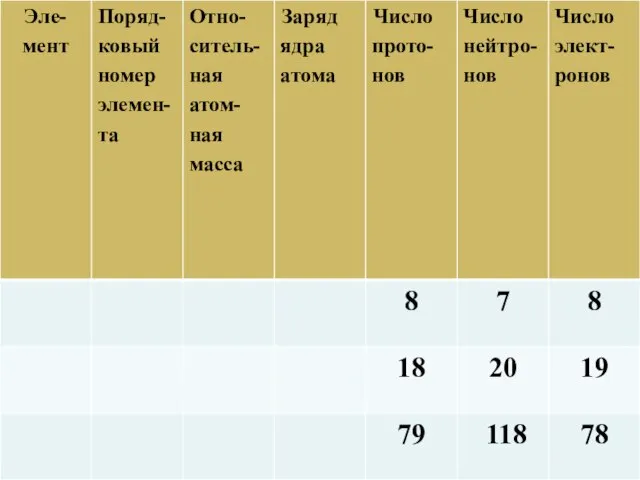
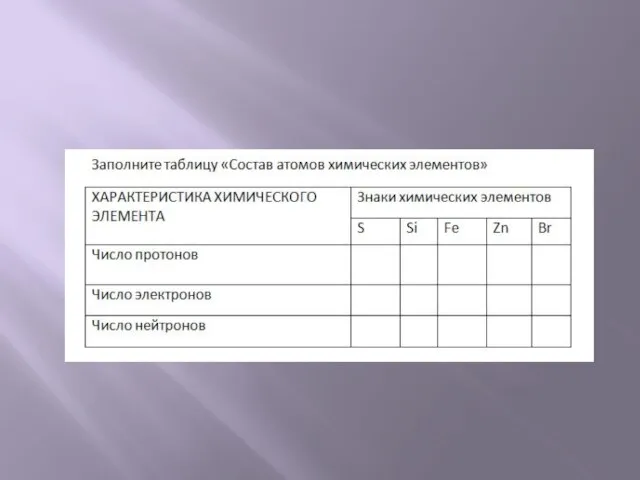
- 14. Число протонов и электронов в атоме равно порядковому номеру элемента. Масса атома складывается из массы протонов
- 16. Периодическая система и строение атома
- 17. Z – порядковый номер химического элемента, указывает на заряд ядра, а следовательно на число протонов, а
- 18. Порядковый Заряд Число номер = ядра = электронов элемента атома в атоме
- 19. Порядковый Заряд Число Число номер = ядра = электронов = протонов элемента атома в атоме в
- 20. N=А- Z;
- 21. НАПРИМЕР СТРОЕНИЕ АТОМА УГЛЕРОДА 6 протонов 6 электронов 6 нейтронов
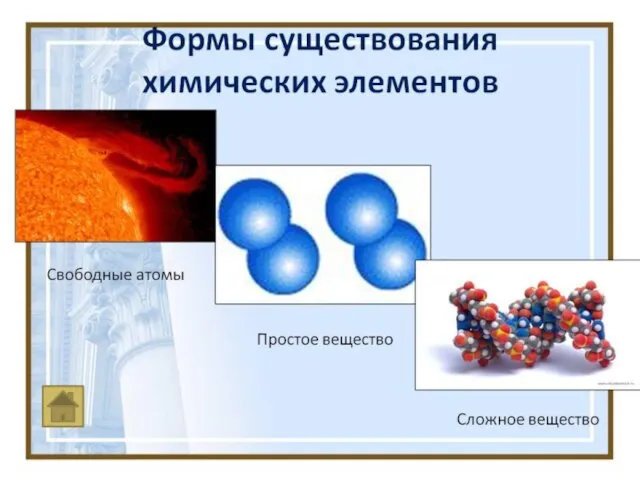
- 22. Основные выводы Атом является мельчайшей частицей вещества Вся масса атома сосредоточена в его ядре, объем которого
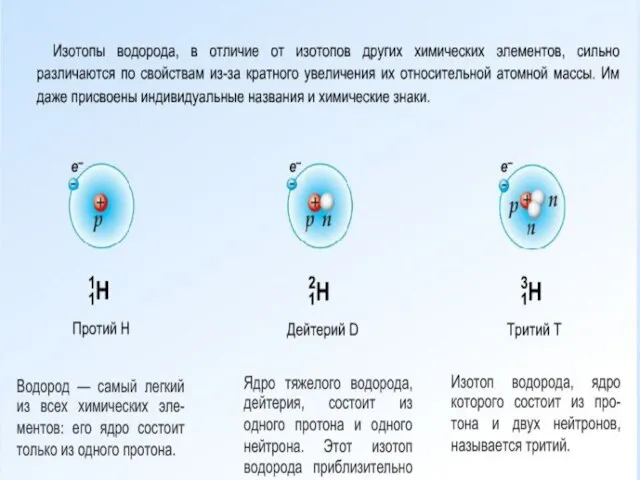
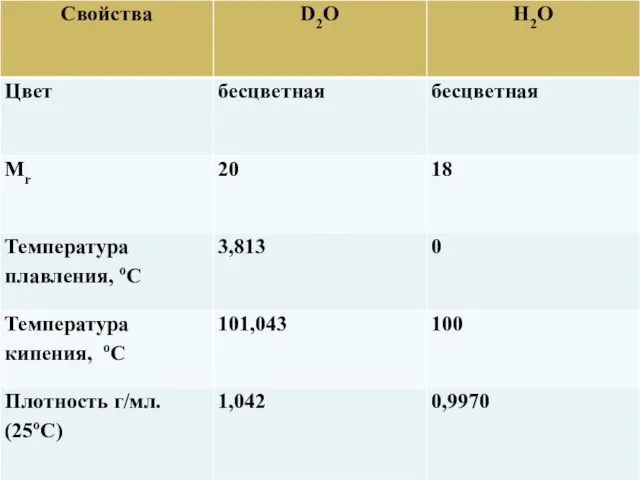
- 24. Изотопы – это разновидности атомов одного химического элемента, имеющие одинаковое число протонов и электронов, но разное
- 25. Изотопы
- 26. + Масса изотопа-1 * распростра-ненность Масса изотопа-2 * распростра-ненность Аr =
- 27. Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
- 34. Выберите верные утверждения Ядро атома содержит протоны и нейтроны, суммарная масса которых равна массовому числу атома.
- 35. Выберите верные утверждения Ядро атома содержит протоны и нейтроны, суммарная масса которых равна массовому числу атома.
- 38. Домашнее задание; § 6 – повторить; § 7 § 8 – учить; письменно выполнить 2 стр.
- 39. Тест по теме «Строение атома» 1. Положительно заряженная частица называется А) электронБ) протонВ) нейтрон 2. Отрицательно
- 40. Вставьте пропущенные слова 2. Вся масса атома сосредоточена в . Число нейтронов = -
- 41. Оценка своего эмоционального состояния учащимися
- 43. Скачать презентацию













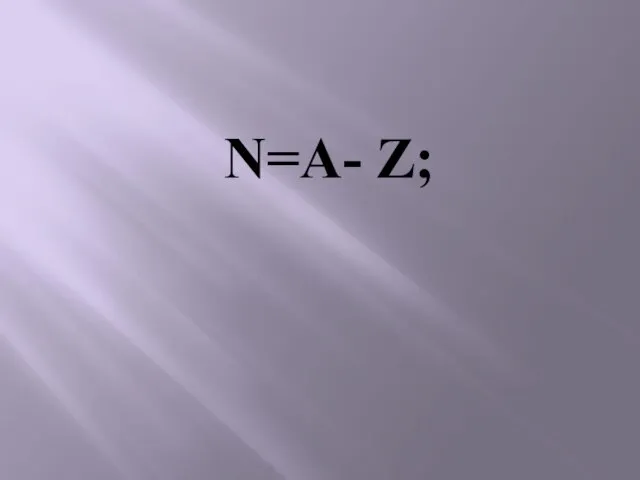














 Тосол. Гликолевые антифризы
Тосол. Гликолевые антифризы Презентация на тему Химический алфавит
Презентация на тему Химический алфавит  Термодинамика. Лекция №2
Термодинамика. Лекция №2 Пористые стекла
Пористые стекла 897386 (2)
897386 (2) Презентация на тему Дисахариды
Презентация на тему Дисахариды  Арены. Бензол
Арены. Бензол Хром. Месторождения
Хром. Месторождения Окислительно-восстановительные реакции. Метод электронного баланса
Окислительно-восстановительные реакции. Метод электронного баланса Алканы. Свойства. Строение и применение
Алканы. Свойства. Строение и применение Образование и получение веществ
Образование и получение веществ Презентация на тему Водород (9 класс)
Презентация на тему Водород (9 класс)  Стекло. Определение стекла
Стекло. Определение стекла Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования:
Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования: Строение и химические свойства галогенов
Строение и химические свойства галогенов Автоматизация процесса сушки миксера печи СКН
Автоматизация процесса сушки миксера печи СКН Каучук. История открытия каучука
Каучук. История открытия каучука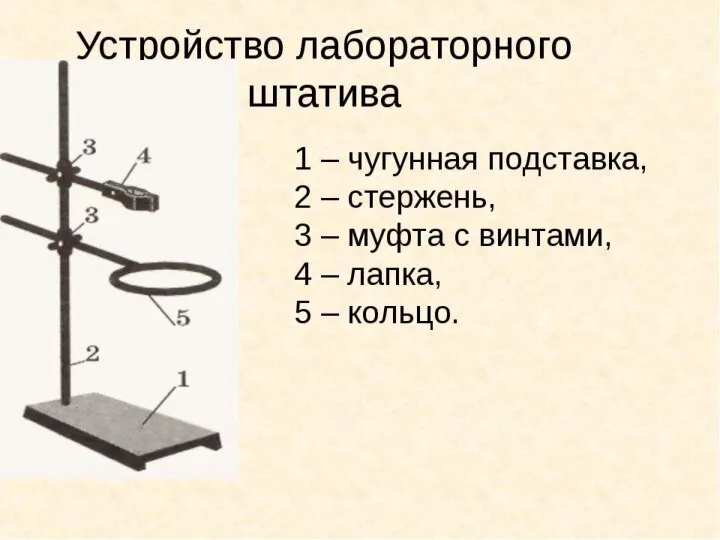 Устройство лабораторного штатива
Устройство лабораторного штатива Химические свойства алкенов. Получение
Химические свойства алкенов. Получение Дисперсные системы
Дисперсные системы Электрохимия. Экзаменационные вопросы
Электрохимия. Экзаменационные вопросы Занимательные задачи по химии
Занимательные задачи по химии Химические реакции
Химические реакции Химия и нанотехнологии
Химия и нанотехнологии Презентация на тему Коррозия
Презентация на тему Коррозия  Химическое сопротивление материалов
Химическое сопротивление материалов Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Алканы и алкены
Алканы и алкены