Содержание
- 6. Нахождение в природе В земной коре хлор - самый распространённый галоген. Поскольку хлор очень активен, в
- 7. Сильвин KCl Сильвин, Германия. Музей им. А.Е.Ферсмана Сильвин и галит, Соликамск. Музей им. А.Е.Ферсмана Сильвинит KCl
- 8. Бишофит MgCl2·6H2O Бишофит. Минерал Волгоградской области
- 9. Карналлит KCl·MgCl2·6Н2O Рудник №2, Прикарпатье, Украина Галит и карналлит
- 10. Каинит KCl·MgSO4·3Н2О Каинит. Брауншвейг, Германия Калуш,Украина
- 11. Характеристика химического элемента Хлор – элемент VII А группы. Порядковый номер 17 Относительная атомная масса: 35,4527
- 12. Электронная формула: Типичные степени окисления: -1, 0, +1, +3, +4, +5, +7 Энергия ионизации: 1254,9(13,01) кДж/моль
- 13. Характеристика простого вещества Тип связи: ковалентная неполярная Молекула двухатомная Изотопы: 35Cl (75,78 %) и 37Cl(24,22 %)
- 14. Термодинамические параметры
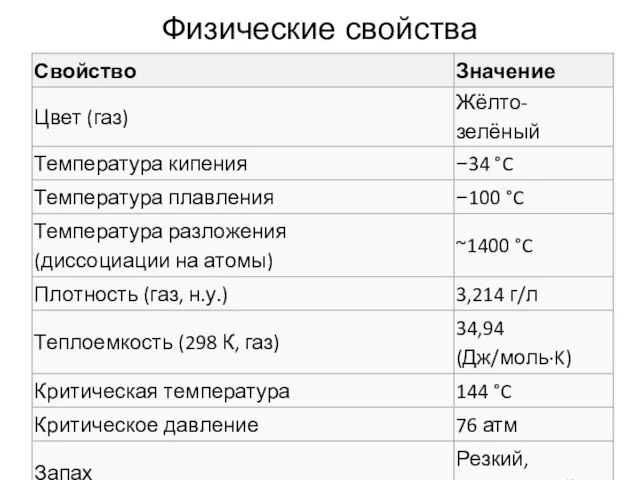
- 15. Физические свойства
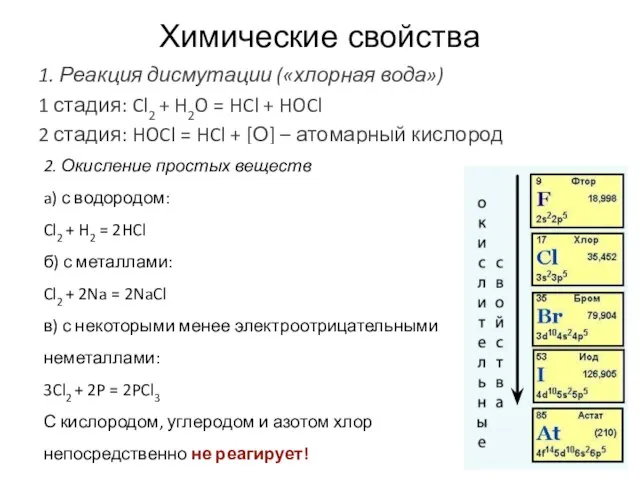
- 16. Химические свойства 1. Реакция дисмутации («хлорная вода») 1 стадия: Cl2 + H2O = HCl + HOCl
- 17. 3. Взаимодействие со сложными веществами а) с водой: см. выше реакция дисмутации б) с кислородсодержащими кислотами:
- 18. Важнейшие соединения хлора Хло́роводоро́д, хло́ристый водоро́д (HCl) Бесцветный, термически устойчивый газ (при н.у.) с резким запахом,
- 19. Свойства соляной кислоты: Очень устойчива к нагреванию В воде кислота Слабый окислитель по протону Под действием
- 20. Как окислитель реагирует: Mg + 2 HCl → MgCl2 + H2↑ Конц. соляная кислота реагирует с
- 21. Смесь 3v HCl : 1v HNO3 называется «царской водкой». Она способна растворять даже золото и платину.
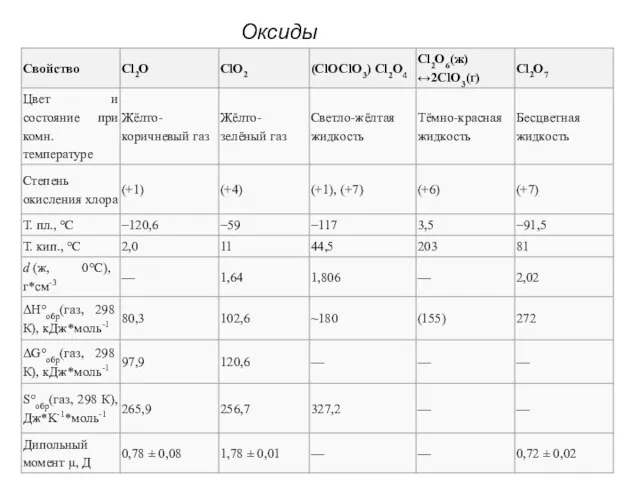
- 22. Оксиды хлора
- 23. Оксид хлора (I), оксид дихлора, ангидрид хлорноватистой кислоты (Cl2O) В нормальных условиях представляет собой буровато-жёлтый газ
- 24. Диоксид хлора, оксид хлора (IV), (ClO2) В нормальных условиях газ красновато-жёлтого цвета, с характерным запахом. При
- 25. Проявляет окислительно-восстановительные свойства. 2ClO2 + 5H2SO4 (разб.) + 10FeSO4 = 5Fe2(SO4)3 + 2HCl + 4H2O ClO2
- 26. Хлорноватистая кислота (HClO) Очень слабая одноосновная кислота, в которой хлор имеет степень окисления +1. Существует лишь
- 27. Хлористая кислота (HClO2) Одноосновная кислота средней силы. В свободном виде неустойчива, даже в разбавленном водном растворе
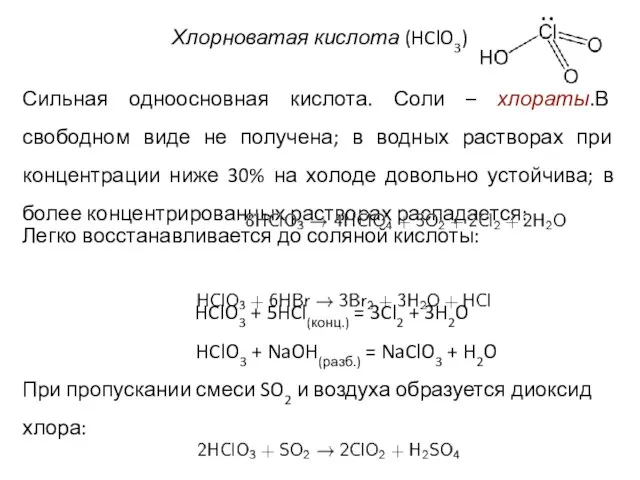
- 28. Хлорноватая кислота (HClO3) Сильная одноосновная кислота. Соли – хлораты.В свободном виде не получена; в водных растворах
- 29. Получение Химические методы получения хлора малоэффективны и затратны. На сегодняшний день имеют в основном историческое значение:
- 30. Получение Метод Дикона Метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Электрохимические методы Сегодня хлор в
- 31. Самые большие запасы хлора содержатся в составе солей вод морей и океанов
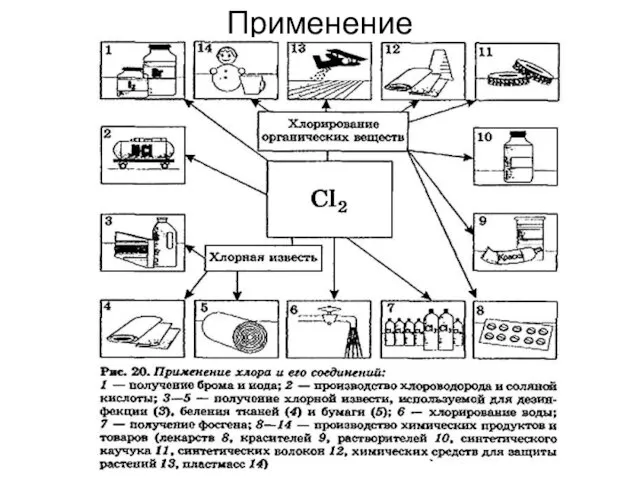
- 32. Применение
- 33. Физиологическое действие Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье.
- 34. Бром и его пары сильно токсичны. Уже при содержании брома в воздухе в концентрации около 0,001
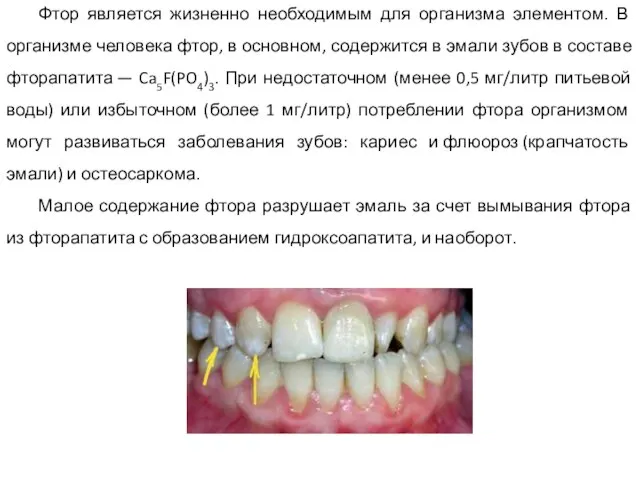
- 35. Фтор является жизненно необходимым для организма элементом. В организме человека фтор, в основном, содержится в эмали
- 37. Скачать презентацию




























 Основы химического анализа. Лекция 7
Основы химического анализа. Лекция 7 Введение в дисциплину Процессы и аппараты химической технологии
Введение в дисциплину Процессы и аппараты химической технологии Алканы. Циклоалканы
Алканы. Циклоалканы Разработка системы подготовки лаборанта химического анализа
Разработка системы подготовки лаборанта химического анализа Серная кислота
Серная кислота Презентация на тему Актуальные проблемы газовой отрасли России
Презентация на тему Актуальные проблемы газовой отрасли России  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Основные классы неорганических соединений
Презентация на тему Основные классы неорганических соединений  Процес сушіння тонкодисперсної пасти діоксиду титану
Процес сушіння тонкодисперсної пасти діоксиду титану Кальций и его соединения
Кальций и его соединения Природные источники углеводородов
Природные источники углеводородов Увлекательный мир науки и практики
Увлекательный мир науки и практики Канифоль. Физико-химические показатели
Канифоль. Физико-химические показатели Химические методы количественного анализа веществ
Химические методы количественного анализа веществ Химия растворов
Химия растворов Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Презентация на тему Сведения о воде
Презентация на тему Сведения о воде  Химическая организация природы
Химическая организация природы Викторина Важнейшие классы веществ. Химические реакции. 8 класс
Викторина Важнейшие классы веществ. Химические реакции. 8 класс Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты
Карбоновые кислоты и их гетерофункциональные производные: гидрокси- и оксокарбоновые кислоты Номенклатура и изомерия карбоновых кислот
Номенклатура и изомерия карбоновых кислот Выделение и модификация древесных полимеров с получением биоактивных полимеров и матриц
Выделение и модификация древесных полимеров с получением биоактивных полимеров и матриц Решение экспериментальных задач по теме Металлы
Решение экспериментальных задач по теме Металлы Personal сare. Akypo Foam Rl 40
Personal сare. Akypo Foam Rl 40 Методы диагностики плазмы
Методы диагностики плазмы Химическая связь
Химическая связь Простые вещества металлы
Простые вещества металлы тэд — без анимации(1)
тэд — без анимации(1)