Содержание
- 2. История создания 1840 г. – Ю.Ф.Фрицше обнаружил, что при нагревании с щелочью синяя окраска индиго исчезает
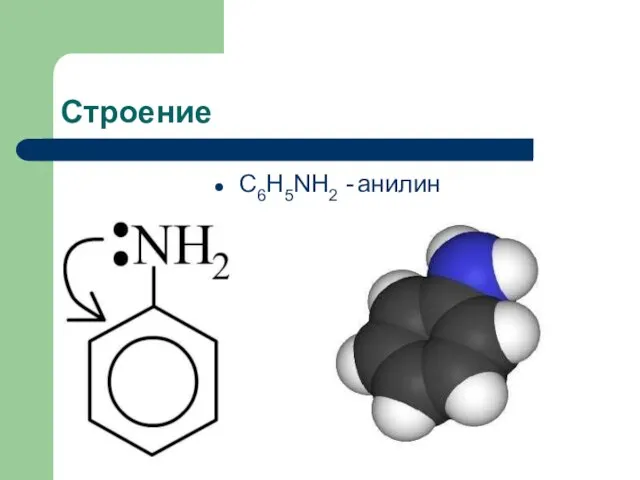
- 3. Строение C6H5NH2 - анилин
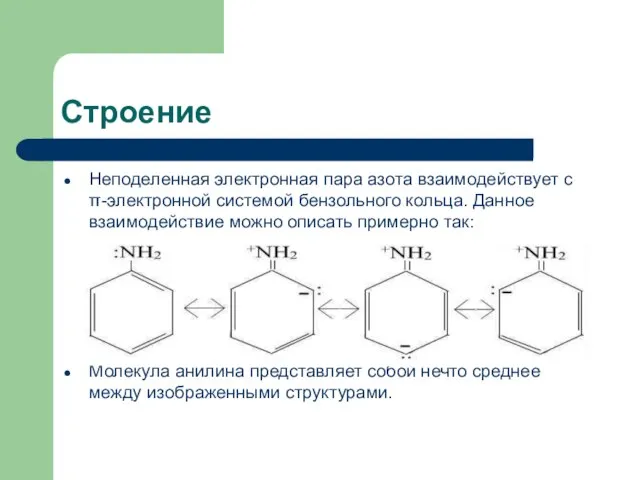
- 4. Строение Неподеленная электронная пара азота взаимодействует с π-электронной системой бензольного кольца. Данное взаимодействие можно описать примерно
- 5. Общая информация о строении Эти структурные формулы показывают, что электронная пара азота втягивается в бензольное кольцо,
- 6. Физические свойства Анилин - бесцветная маслянистая жидкость. При окислении на воздухе становится светло-коричневого цвета. Немного тяжелее
- 7. Получение В промышленности C6H5NO2 + 3H2 250-300C,Ni,Cu C6H5NH2 + 2H2O C6H5NO2 + 6[H] Fe,HCl,H2O C6H5NH2 +
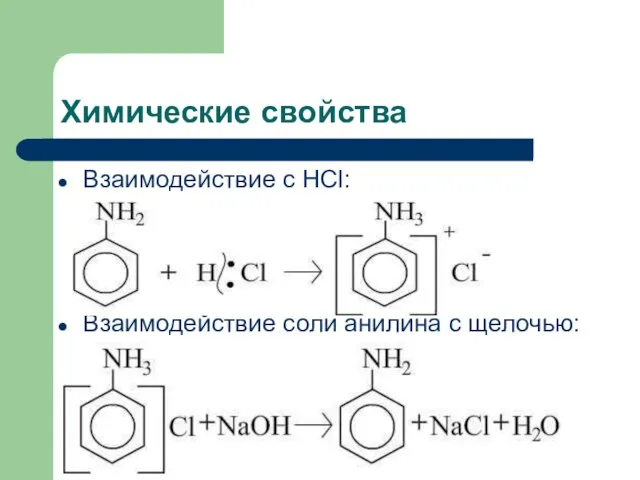
- 8. Химические свойства Взаимодействие с HCl: Взаимодействие соли анилина с щелочью:
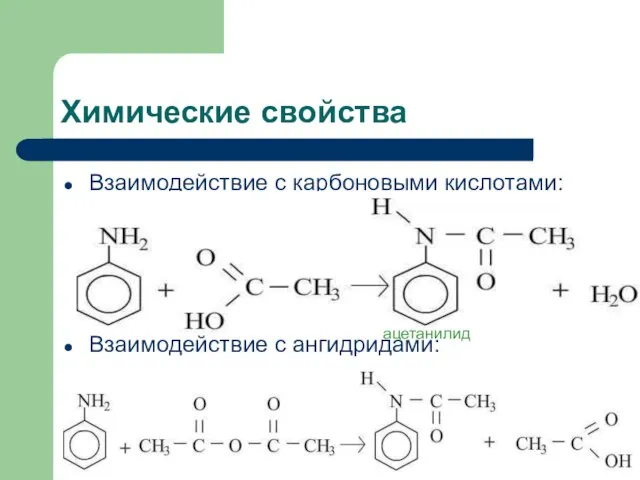
- 9. Химические свойства Взаимодействие с карбоновыми кислотами: Взаимодействие с ангидридами:
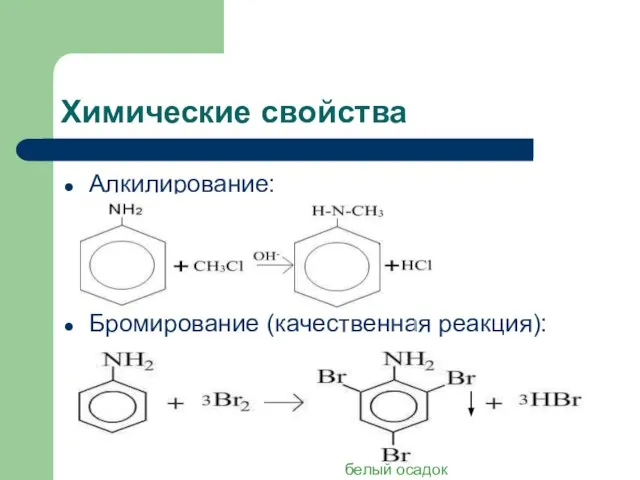
- 10. Химические свойства Алкилирование: Бромирование (качественная реакция): белый осадок
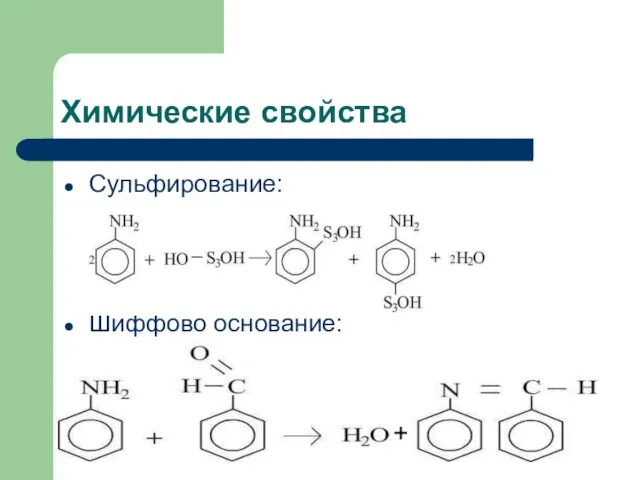
- 11. Химические свойства Сульфирование: Шиффово основание:
- 12. Химические свойства Нитрование: C6H5NH2+NaNO2+2HCl [C6H5-N≡N]+Cl- +NaCl + 2H2O хлорид диазония Диазосоединения можно выделить в виде кристаллических,
- 13. Применение В настоящий момент в мире основная часть (85%) производимого анилина используется для производства метилдиизоционатов (MDI),
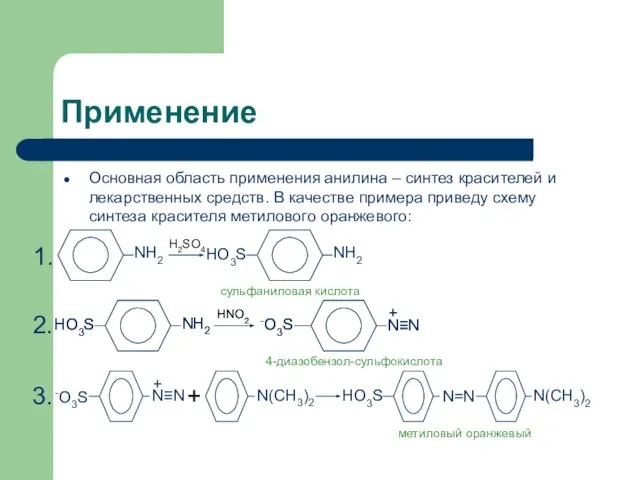
- 14. Применение Основная область применения анилина – синтез красителей и лекарственных средств. В качестве примера приведу схему
- 16. Скачать презентацию




![Химические свойства Нитрование: C6H5NH2+NaNO2+2HCl [C6H5-N≡N]+Cl- +NaCl + 2H2O хлорид диазония Диазосоединения можно](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/480258/slide-11.jpg)

 Презентация на тему Палладий
Презентация на тему Палладий  Природные источники углеводородов
Природные источники углеводородов Аргументы к апелляции на ЕГЭ по химии 2021
Аргументы к апелляции на ЕГЭ по химии 2021 Дисперсные системы с твёрдой средой и газообразной фазой
Дисперсные системы с твёрдой средой и газообразной фазой Аналитическая химия. Введение
Аналитическая химия. Введение Презентация на тему Использование информационных технологий на уроках химии
Презентация на тему Использование информационных технологий на уроках химии  Классификация нефтей. Основы переработки нефти и нефтепродуктов
Классификация нефтей. Основы переработки нефти и нефтепродуктов Физическое явление в химии
Физическое явление в химии Презентация на тему Характеристика щелочных металлов 9 класс
Презентация на тему Характеристика щелочных металлов 9 класс  Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Виробництво 4-амінофенолу потужністю 670 т/рік з розробкою стадії відновлення
Виробництво 4-амінофенолу потужністю 670 т/рік з розробкою стадії відновлення Презентация на тему Законы электролиза
Презентация на тему Законы электролиза  Презентация на тему Азотная кислота
Презентация на тему Азотная кислота  Лекарственные средства – производные пиримидин 2,4,6-триона
Лекарственные средства – производные пиримидин 2,4,6-триона относительная атомная масса
относительная атомная масса Алкадиены: строение, номенклатура, гомологи, изомерия
Алкадиены: строение, номенклатура, гомологи, изомерия День химии
День химии Интеллектуальная игра по химии, биологии, географии. Роль химических соединений. 10 класс
Интеллектуальная игра по химии, биологии, географии. Роль химических соединений. 10 класс Презентация на тему Каучук
Презентация на тему Каучук  Химический Пентагон. Интеллектуальная игра для учащихся 10-11 классов
Химический Пентагон. Интеллектуальная игра для учащихся 10-11 классов Химическая замена
Химическая замена Основания, их состав и название
Основания, их состав и название Основные классы неорганических соединений
Основные классы неорганических соединений Сложные неорганические вещества
Сложные неорганические вещества Які існують способи розділення сумішей?
Які існують способи розділення сумішей? Кислоты. Тест
Кислоты. Тест Педагогические измерительные материалы ХИМИЯ Варганова Ирина Вячеславовна, и.о. зав. кафедрой естественно-математических дисцип
Педагогические измерительные материалы ХИМИЯ Варганова Ирина Вячеславовна, и.о. зав. кафедрой естественно-математических дисцип Презентация на тему Графен - материал будущего
Презентация на тему Графен - материал будущего