Слайд 3Вещества с ионной (NaCl) и ковалентной полярной связью (HCl) диссоциируют в водных
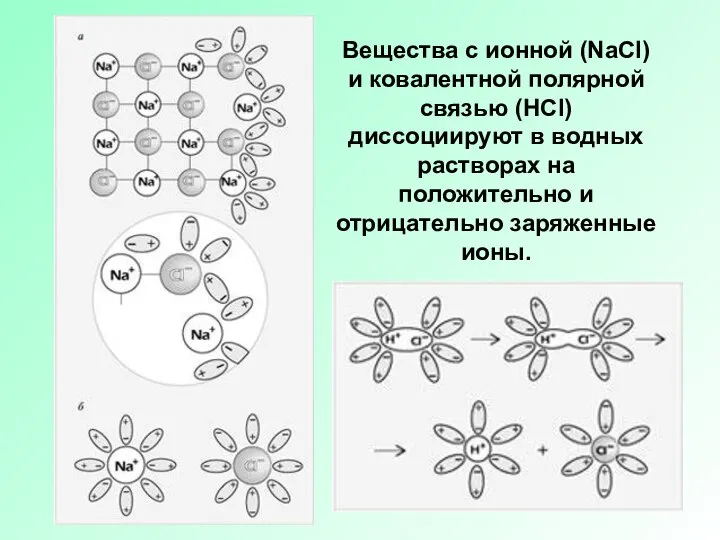
растворах на положительно и отрицательно заряженные ионы.
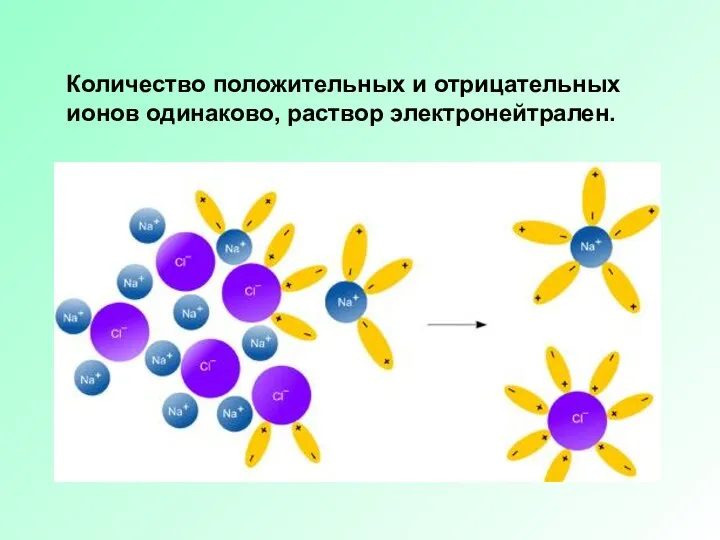
Слайд 4Количество положительных и отрицательных ионов одинаково, раствор электронейтрален.
Слайд 5Ионы в растворе находятся в беспорядочном движении, а при пропускании электрического тока
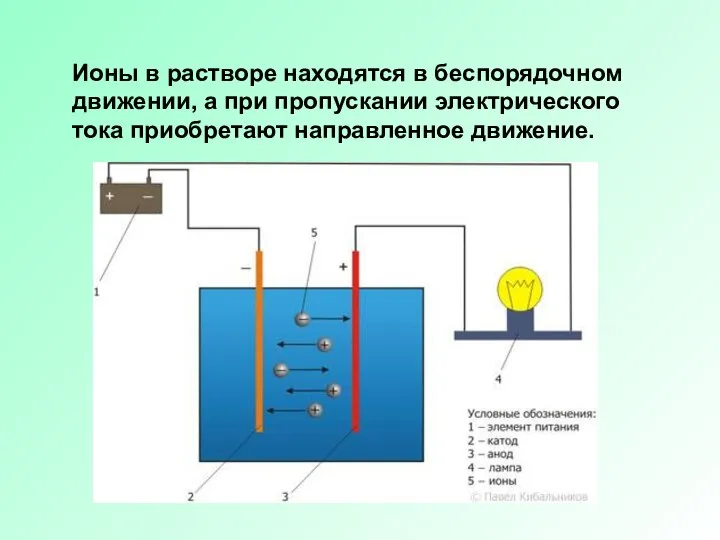
приобретают направленное движение.
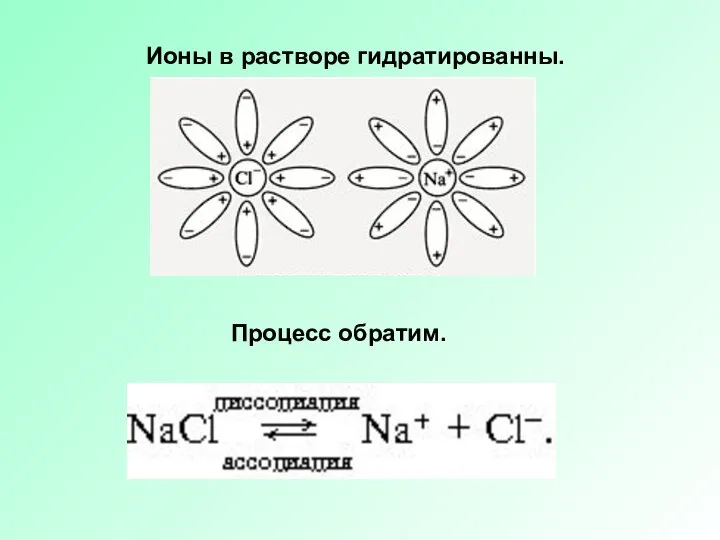
Слайд 6Ионы в растворе гидратированны.
Процесс обратим.
Слайд 7Сванте Аррениус
установил факт диссоциации

Слайд 8Каблуков Иван Алексеевич
установил роль воды в процессе электролитической диссоциации
Кистяковский Владимир Александрович

объединил взгляды Аррениуса, Каблукова и теорию растворов Менделеева и сформулировал основные положения ТЭД
Слайд 9Испытание веществ на электропроводность

Слайд 10Зависимость электропроводности от концентрации

Слайд 11Изменение диссоциации при температуре

Слайд 12Степень электролитической диссоциации

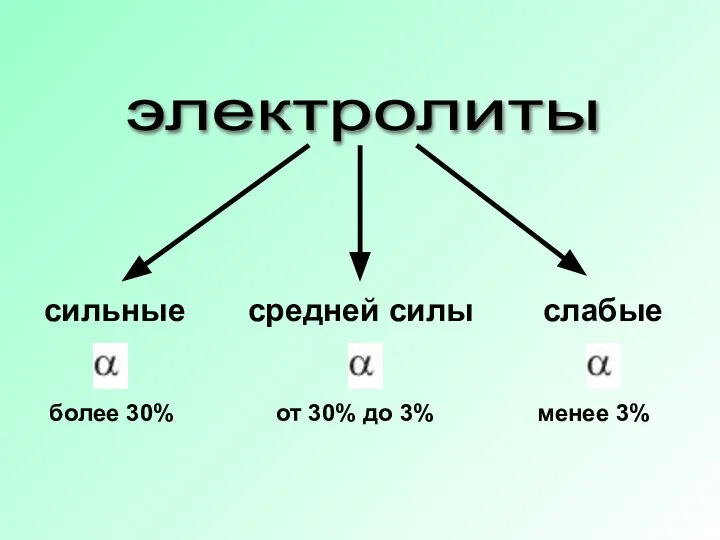
Слайд 13электролиты
сильные
средней силы
слабые
более 30%
от 30% до 3%
менее 3%












 Дисперсные системы. Лекция №7
Дисперсные системы. Лекция №7 Бинарные соединения – оксиды и летучие водородные соединения. 8 класс
Бинарные соединения – оксиды и летучие водородные соединения. 8 класс Железо - основа всего мира
Железо - основа всего мира Презентация на тему Классификация кислот
Презентация на тему Классификация кислот  Пакет заданий №2. Команда вечерний дозор
Пакет заданий №2. Команда вечерний дозор Получение меди
Получение меди Полезные кирпичи окружающего мира
Полезные кирпичи окружающего мира Презентация на тему Жидкое состояние вещества
Презентация на тему Жидкое состояние вещества  Умники и умницы в Королевстве Химических наук
Умники и умницы в Королевстве Химических наук Водород
Водород Презентация на тему: Изомерия
Презентация на тему: Изомерия Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2)
Современная ВЭЖХ. Круг анализируемых объектов. Сорбенты и подвижные фазы для ВЭЖХ. (Лекция 2)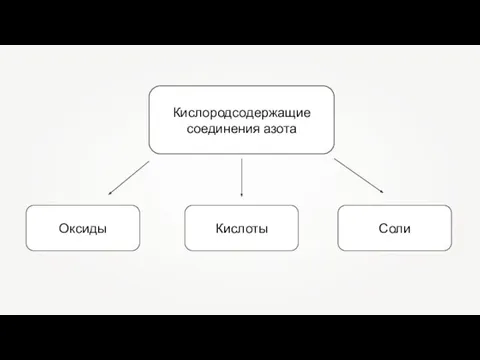 Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Присоединение аммиака и аминов
Присоединение аммиака и аминов Решение задач. Подготовка к контрольной работе по химии
Решение задач. Подготовка к контрольной работе по химии Приготовление и хранение индикаторов для исследований
Приготовление и хранение индикаторов для исследований Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Вязкоупругие свойства полимеров
Вязкоупругие свойства полимеров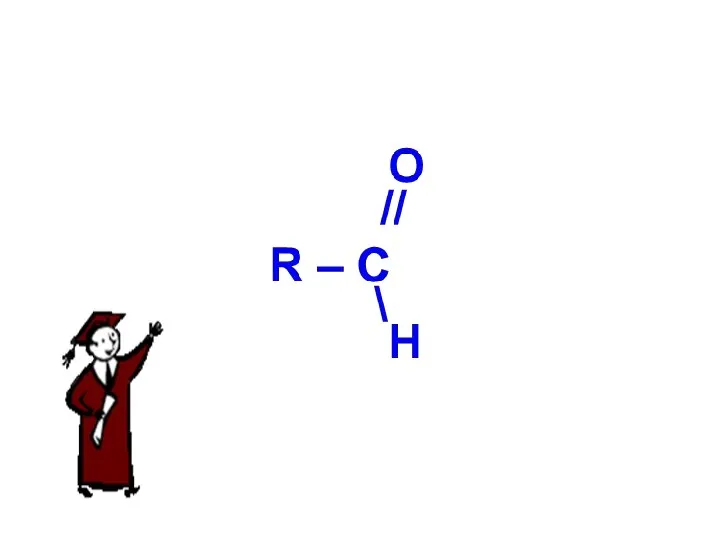 Карбоновые кислоты
Карбоновые кислоты Презентация на тему Стекло
Презентация на тему Стекло  Тайна алмазов
Тайна алмазов ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ
ТЕМА: БОЛЬШОЙ КРУГОВОРОТ ВЕЩЕСТВ Углеродистые стали
Углеродистые стали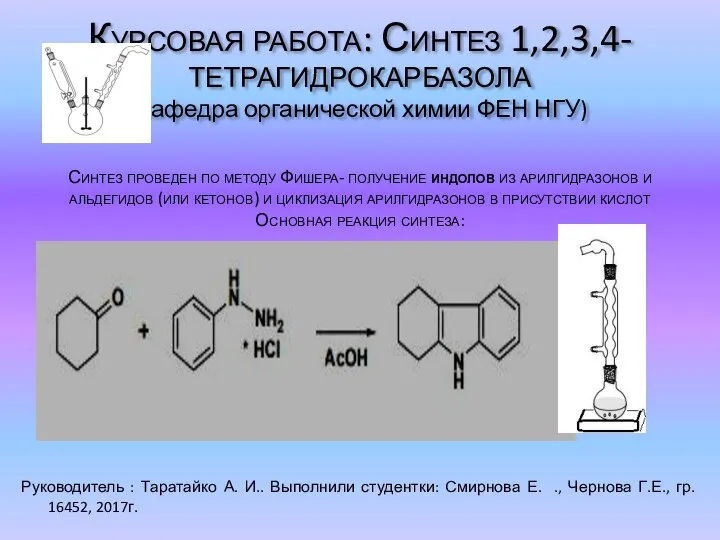 Синтез 1,2,3,4-тетрагидрокарбазола
Синтез 1,2,3,4-тетрагидрокарбазола Непредельные углеводороды
Непредельные углеводороды Химическая кинетика
Химическая кинетика Изучаем химию с Агатой Кристи
Изучаем химию с Агатой Кристи Строение вещества
Строение вещества