Содержание
- 2. Габер Фриц Синтез аммиака – процесс связывания азота, который впервые осуществил известный немецкий химик - неорганик
- 3. Карл Бош Немецкие исследователи Ф.Габер и К.Бош создали циркуляционную схему синтеза аммиака под давлением. В 1913
- 4. Условия для проведения синтеза N2 + 3H2 = 2NH3 Реакция обратимая, гомогенная и идет с уменьшением
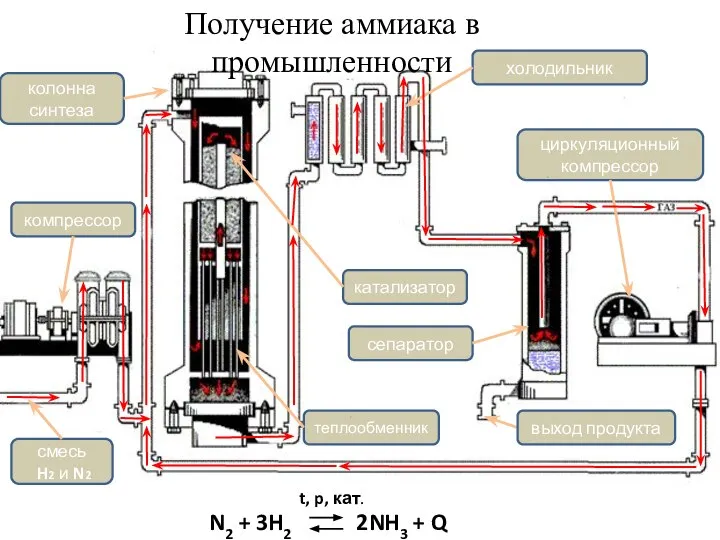
- 5. Получение аммиака в промышленности теплообменник катализатор выход продукта циркуляционный компрессор колонна синтеза
- 6. Другие способы получения аммиака: Дуговой метод Дуговой метод основан на прямом окислении азота атмосферным воздухом при
- 7. Применение аммиака удобрения пищевая промышленность (хладагент) -аммиачная вода -мочевина -сода HNO3
- 8. Действие аммиака на организм Аммиак сильно раздражает слизистые оболочки уже при 0,5%-ном содержании его в воздухе.
- 10. Скачать презентацию






 Неметаллы в природе и жизни человека
Неметаллы в природе и жизни человека Моющие и чистящие средства
Моющие и чистящие средства Реакции, подтверждающие взаимосвязь различных
Реакции, подтверждающие взаимосвязь различных Природный газ. Алканы
Природный газ. Алканы Презентация на тему Витамин Е
Презентация на тему Витамин Е  Аммиак. Свойства (9 класс)
Аммиак. Свойства (9 класс) Явление хемилюменисценции
Явление хемилюменисценции Атом. Изотопы
Атом. Изотопы Сокровища соляных дворцов
Сокровища соляных дворцов Классы неорганических соединений
Классы неорганических соединений Углеводороды
Углеводороды Кристаллы. Формирование кристаллов
Кристаллы. Формирование кристаллов Получение азокрасителя в лабораторных условиях
Получение азокрасителя в лабораторных условиях Які існують способи розділення сумішей?
Які існують способи розділення сумішей? Таблица Д.И. Менделеева
Таблица Д.И. Менделеева Поверхность потенциальной энергии и расчет сил, действующих на ионы
Поверхность потенциальной энергии и расчет сил, действующих на ионы Химические свойства бензола. Получение, применение. Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна
Химические свойства бензола. Получение, применение. Учитель биологии-химии МОУ «СОШ р.п. Озинки» Хорова Людмила Владимировна Щелочноземельные металлы
Щелочноземельные металлы Понятие Эффективность. Принцип Ле-Шателье
Понятие Эффективность. Принцип Ле-Шателье Химия и география. Викторина
Химия и география. Викторина Металлы и их соединения
Металлы и их соединения Лекция_классы_неогранических_соединений
Лекция_классы_неогранических_соединений Производство метанола
Производство метанола Основные классы неорганических соединений
Основные классы неорганических соединений Обмен углеводов
Обмен углеводов Номенклатура и изомерия аренов
Номенклатура и изомерия аренов Марганец. Химия элементов. Кислородосодержащие соединения
Марганец. Химия элементов. Кислородосодержащие соединения Презентация на тему Вопросы от …
Презентация на тему Вопросы от …