Содержание
- 2. Цели урока: 1.Сформулировать основные положения теории электролитической диссоциации. 2.Закрепить понятия: ион, катион, анион, Гидратированные и Негидратированные
- 3. План урока: 1. Организационный момент. Проверка домашнего задания. 2.Разбор нового материала: А)основные положения теории ЭД. Б)
- 4. 1.Проверка домашнего задания (опрос по вопросам). 1. Что такое электролиты и не электролиты? 2. Электролитическая диссоциация,
- 5. 3.С каким типом связи характерны этапы растворения веществ: А. 1)ориентация молекул 2)гидратация молекул 3)диссоциация кристалла электролита.
- 6. Процесс распада электролитов на заряженные частицы ─ ионы называют электролитической диссоциацией («dissociation» ─ разобщение). Основные положения
- 7. Основные положения теории электролитической диссоциации: 1.Положение теории. При растворении в воде электролиты диссоциируют (распадаются) на положительные
- 8. Ионы бывают: Простыми: Na+; Fe2+; Cl - и т.д. Назовите еще простые ионы. Сложными: SO4; NO3;
- 9. 2.Положение теории. Причиной диссоциации электролита в водном растворе является его гидратация, т.е. взаимодействие электролита с молекулами
- 10. Гидратированные ионы – в растворах и кристаллогидратах. Негидратированные ионы – безводные соли. Свойства гидратированных и негидратированных
- 11. 3.Положение теории. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника тока –
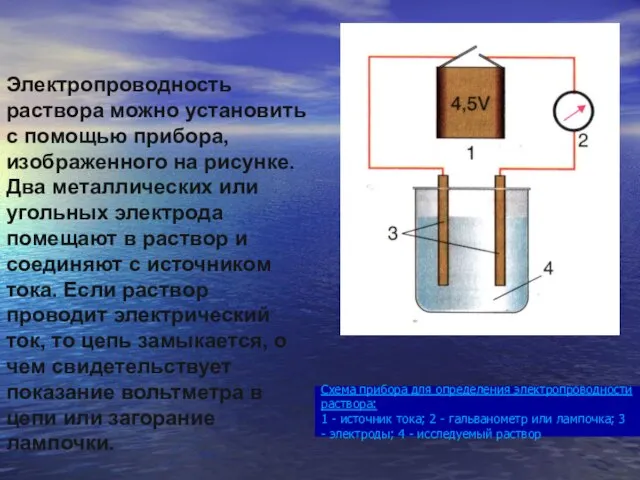
- 12. Схема прибора для определения электропроводности раствора: 1 - источник тока; 2 - гальванометр или лампочка; 3
- 13. 4.Положение теории. Электролитическая диссоциация – процесс обратимый для слабых электролитов. Процесс ассоциации – обратный процесс диссоциации.
- 14. 5.Положение теории. Не все электролиты в одинаковой мере диссоциируют на ионы. Степень диссоциации зависит от природы
- 15. При погружении электродов в дистиллированную воду лампочка не загорается. Чистая вода не проводит электрический ток.
- 16. Не проводит ток и сухая поваренная соль NaCl , если в нее погрузить электроды.
- 17. А вот водный раствор этой же соли проводит электрический ток. Точно так же ведут себя и
- 18. 6.Положение теории. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации. /Диссоциация
- 19. Диссоциация кислот. HNO3 ↔H ++NO3- Многоосновные кислоты. I. H2SO4_= H+ + HSO4_ II. HSO4_↔H ++ SO42-
- 20. Диссоциация оснований. КОН ↔К ++ОН – Многоосновные основания. I. Ва(ОН) 2 = ВаОН + + ОН
- 21. Диссоциация солей. ZnSO4 = Zn 2+ + SO42- Al 2(SO4)3=2Al 3++3SO42- NaCl = Na + +
- 22. Закрепление. Что такое анион? Что такое катион? Чем отличаются катионы и анионы? Что такое катод и
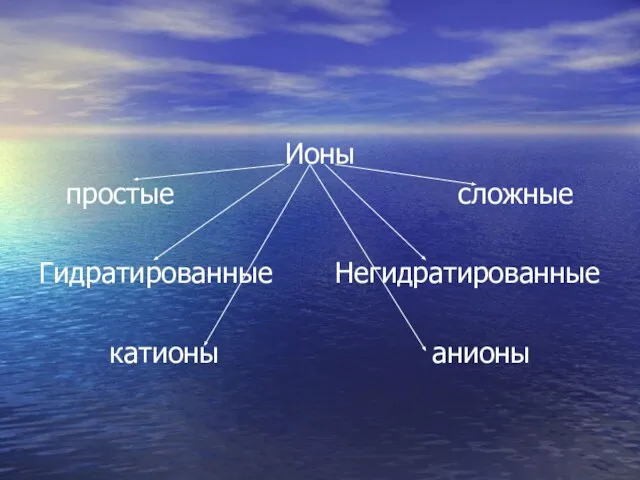
- 23. Закончите схему. Ионы
- 24. Ионы простые сложные Гидратированные Негидратированные катионы анионы
- 26. Скачать презентацию





















 Контроль качества лекарственных средств, производных карбоновых кислот и аминокислот
Контроль качества лекарственных средств, производных карбоновых кислот и аминокислот Analysis of proteins
Analysis of proteins Классификация углеродов
Классификация углеродов Искусственные и синтетические ткани
Искусственные и синтетические ткани Алюминий
Алюминий Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева
Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева  Химия. Вещество
Химия. Вещество MPKh_PREZENTATsIYa_2
MPKh_PREZENTATsIYa_2 Железо
Железо Равновесие в природе. Химическое равновесие
Равновесие в природе. Химическое равновесие Драгоценный металл золото
Драгоценный металл золото Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Презентация на тему Анализ качества питьевой воды
Презентация на тему Анализ качества питьевой воды  Химическая связь
Химическая связь Изомерия и ее виды
Изомерия и ее виды Сопротивление материалов коррозии
Сопротивление материалов коррозии Применение центрифугирования
Применение центрифугирования Салқындатқыш агенттер және оларды салқындату әдістері
Салқындатқыш агенттер және оларды салқындату әдістері Дизельное топливо
Дизельное топливо Щелочные металлы
Щелочные металлы Кислород и озон
Кислород и озон Реакции ионного обмена
Реакции ионного обмена Сера
Сера Кристаллизация и десублимация
Кристаллизация и десублимация Кислоты. Классификация кислот (8 класс)
Кислоты. Классификация кислот (8 класс) Степень окисления
Степень окисления Нанокристаллические и аморфные металлы и сплавы
Нанокристаллические и аморфные металлы и сплавы Современные оборудования в лаборатории
Современные оборудования в лаборатории