Содержание
- 2. Цель урока: Сформировать у учащихся знания о факторах, влияющих на скорость химических реакций.
- 3. Задачи: 1. Исследовать факторы, влияющие на скорость химических реакций и механизм их выполнения; 2. Продолжить развитие
- 4. Методы и методологические приёмы: Диалогический метод изложения знаний с элементами исследования, выполнения демонстрационного и лабораторного эксперимента,
- 5. Средства обучения: - инструкция для выполнения лабораторного эксперимента; - инструкция по технике безопасности; - демонстрационное оборудование;
- 6. Подготовка учащихся к уроку. 1. Деление класса на группы по 5 человек (в каждой группе есть
- 7. Приложение №1.
- 8. 3.Группа получает оборудования и реактивы для проведения эксперимента. 4. Каждый учащийся получает рабочую карту урока (Приложение
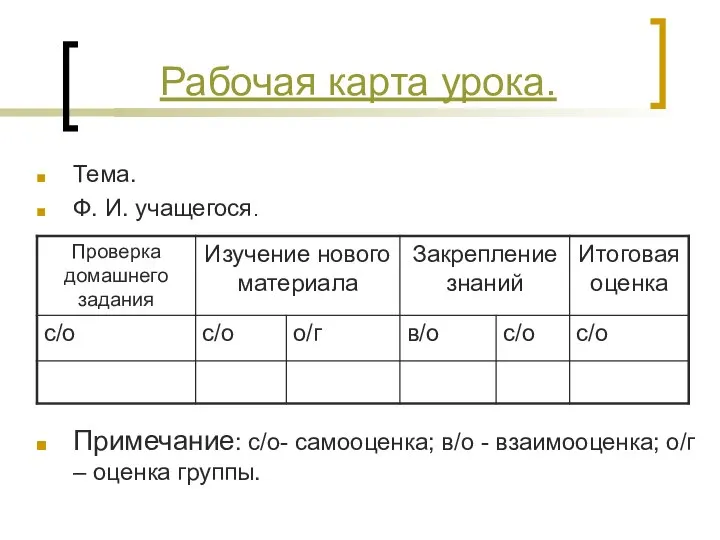
- 9. Тема. Ф. И. учащегося. Примечание: с/о- самооценка; в/о - взаимооценка; о/г – оценка группы. Рабочая карта
- 10. Структура урока. 1. Организационный этап. 2. Актуализация знаний (фронтальная форма работы) 3. Изучение нового материала. 4.
- 11. ХОД УРОКА. I. Организационный этап. II. Актуализация знаний. Примеры реакций. Гомогенные Гетерогенные газ + газ газ
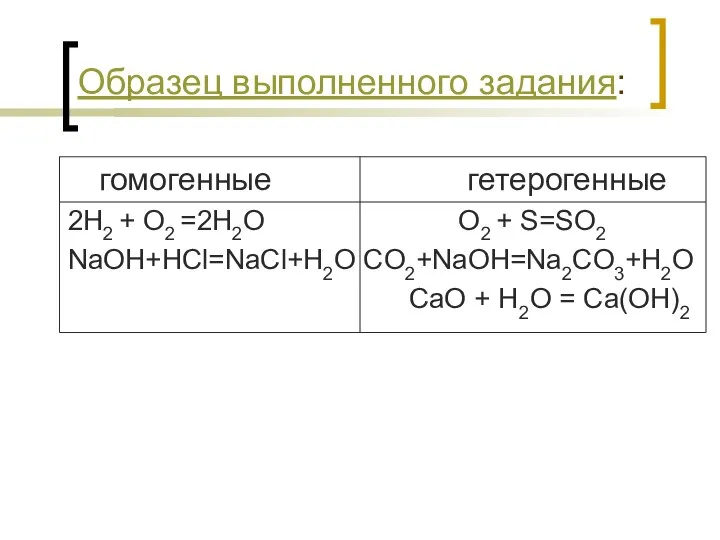
- 12. Образец выполненного задания: гомогенные гетерогенные 2H2 + O2 =2H2O O2 + S=SO2 NaOH+HCl=NaCl+H2O CO2+NaOH=Na2CO3+H2O CaO +
- 13. Таблица №2. Рабочая карта урока. «5» - все примеры составлены верно, «4» - 1 ошибка, «3»
- 14. IIIIII. Изучение нового материала. Тема урока: «Факторы, влияющие на скорость химических реакций». Лабораторный эксперимент. Лабораторный опыт
- 15. Правило Я. Вант-Гоффа V2/V1=γt2-t1/10 Я. Вант-Гофф (1852 -1911). Голландский химик. Один из основателей физической химии и
- 16. Закон действующих масс. Гульдберг (1836-1902). Норвежский физикохимик. П. Вааге (1833-1900). Норвежский ученый. V=kcAacBb
- 17. IVIV. Закрепление знаний (работа в группах, тестирование). Задачи на применение правила Вант-Гоффа и закона действующих масс
- 18. Образцы решенныхОбразцы решенных задач I I группа. N2+3H2=2NH3 V=k·CN2·CH23 V2=k·3CN2·(3CH2)3=81·kCN2CH23 V2/V1=81·kCN2CH23/kCN2CH23=81 V2=81V1
- 19. IIII группаII группа. V2/V1=j(to2-to1) /10 V2/V1=3 (80о-20о) /10о V2/V1=36 V2=729 V1
- 20. III III группа. V2/V1=j(to2-to1) /10 V2/V1=3 (200о -150о) /10о V2/V1=35 V2=243 V1
- 21. IV IV группа. H2 + Cl2= 2HCl V1 = kCH2·CCl2 V2 = k·(4CH2) ·1/2 CCl2 V2
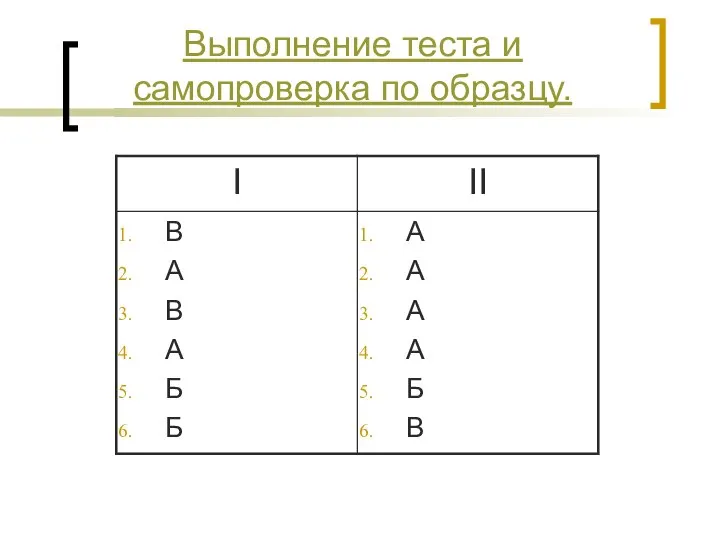
- 22. Выполнение теста и самопроверка по образцу.
- 23. VV.V. V. Рефлексия (самооценка). Каждый учащийся выставляет себе итоговую оценку за урок в рабочей карте и
- 25. Скачать презентацию


















 Окислительно-восстановительные реакции. Электролиз
Окислительно-восстановительные реакции. Электролиз Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Сложные эфиры. Содержание. Определение
Сложные эфиры. Содержание. Определение Соли: классификация, получение, номенклатура
Соли: классификация, получение, номенклатура ГИА по химии 2010-2011
ГИА по химии 2010-2011 Электролиз
Электролиз SHOT.шампуни. Состав. Компоненты
SHOT.шампуни. Состав. Компоненты Химические реакции (2)
Химические реакции (2) Алкины: получение и применение
Алкины: получение и применение Изомерия органических соединений. Лекция 2
Изомерия органических соединений. Лекция 2 Неорганические окислители и восстановители
Неорганические окислители и восстановители Химия элементов IVA группы
Химия элементов IVA группы Белки
Белки Положение металлов в Периодической системе химических элементов Д.И.Менделеева
Положение металлов в Периодической системе химических элементов Д.И.Менделеева Природные источники углеводородов
Природные источники углеводородов Вода-растворитель. Растворы
Вода-растворитель. Растворы Сахароза (С12Н22О11)
Сахароза (С12Н22О11) Алканы
Алканы Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Современные способы защиты ОТТ
Современные способы защиты ОТТ Кислородсодержащие органические вещества
Кислородсодержащие органические вещества Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Окислительные свойства концентрированной серной кислоты
Окислительные свойства концентрированной серной кислоты Химические реакции. Классификация
Химические реакции. Классификация Примеры карбоновых кислот
Примеры карбоновых кислот Стан електронів у атомі
Стан електронів у атомі Реакция Фриделя-Крафтса
Реакция Фриделя-Крафтса Железо
Железо