Содержание
- 2. Вода-универсальный растворитель.
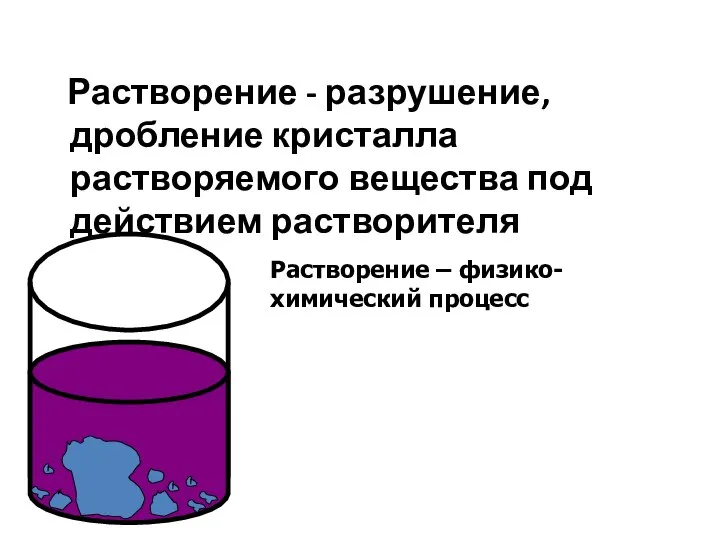
- 3. Растворение - разрушение, дробление кристалла растворяемого вещества под действием растворителя Растворение – физико-химический процесс
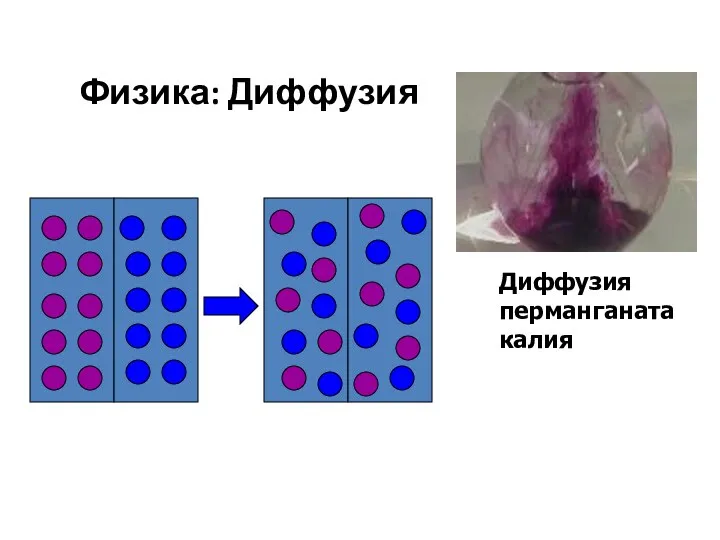
- 4. Физика: Диффузия Диффузия перманганата калия
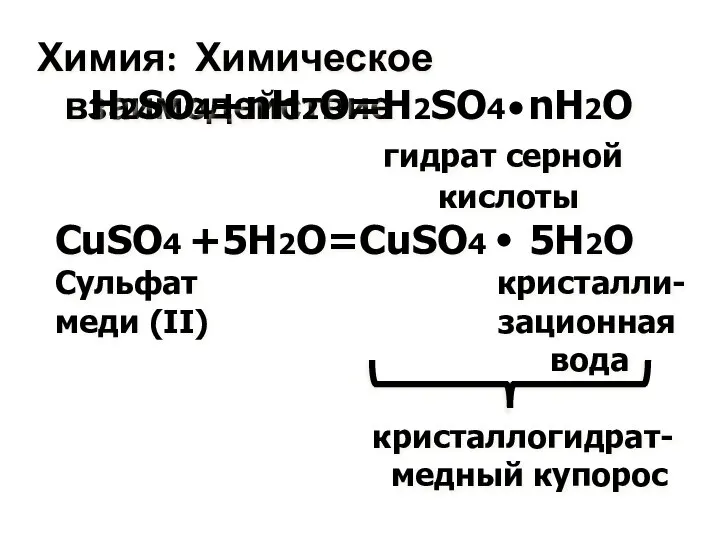
- 5. Химия: Химическое взаимодействие H2SO4+nH2O=H2SO4 nH2O гидрат серной кислоты CuSO4 +5H2O=CuSO4 5H2O Сульфат кристалли- меди (II) зационная
- 6. Раствор - это однородная система, состоящая из растворителя, растворяемого вещества и продуктов их взаимодействия
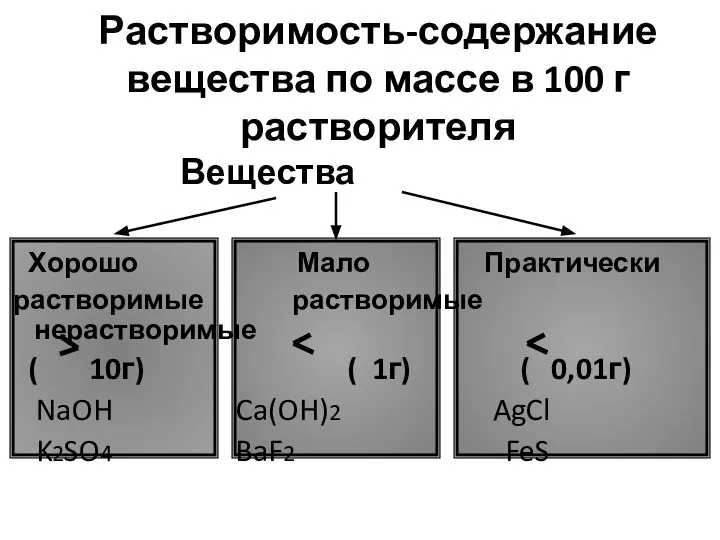
- 7. Растворимость-содержание вещества по массе в 100 г растворителя Вещества Хорошо Мало Практически растворимые растворимые нерастворимые (
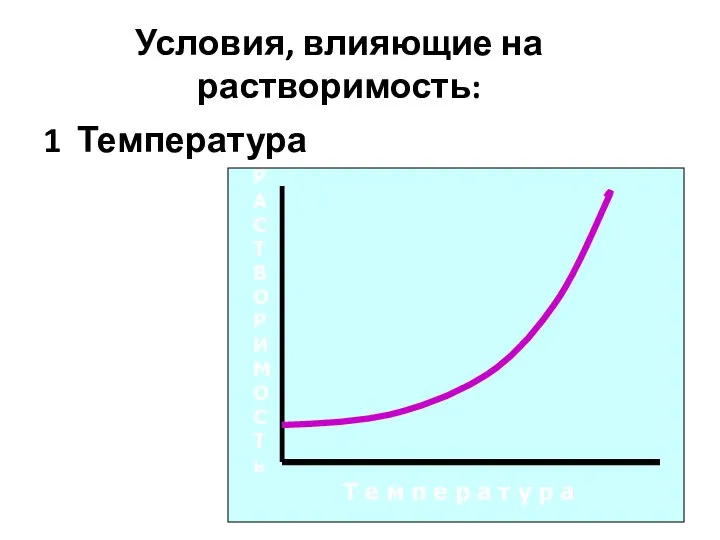
- 8. Условия, влияющие на растворимость: 1 Температура
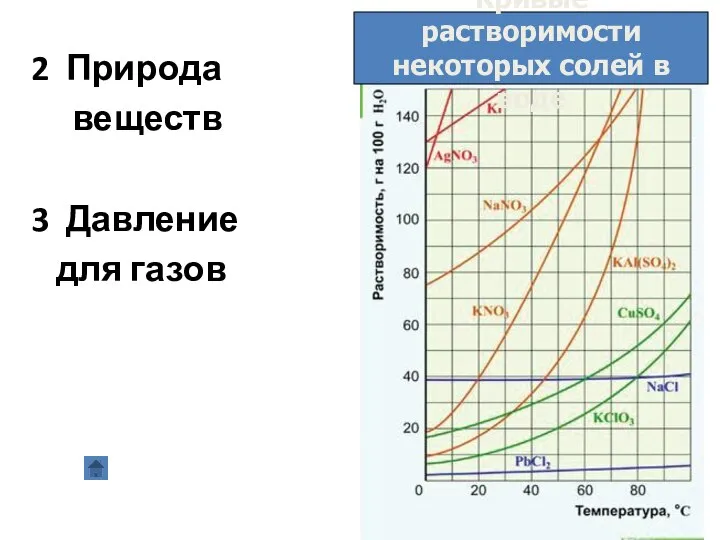
- 9. 2 Природа веществ 3 Давление для газов
- 11. Бытовые растворы Строительные растворы
- 12. Медицинские растворы Химические растворы
- 13. Пищевые растворы Косметические растворы
- 14. Задачи Зародыш человека на 85-90% состоит из воды. В организме взрослого человека-65% воды. Рассчитайте массу воды,
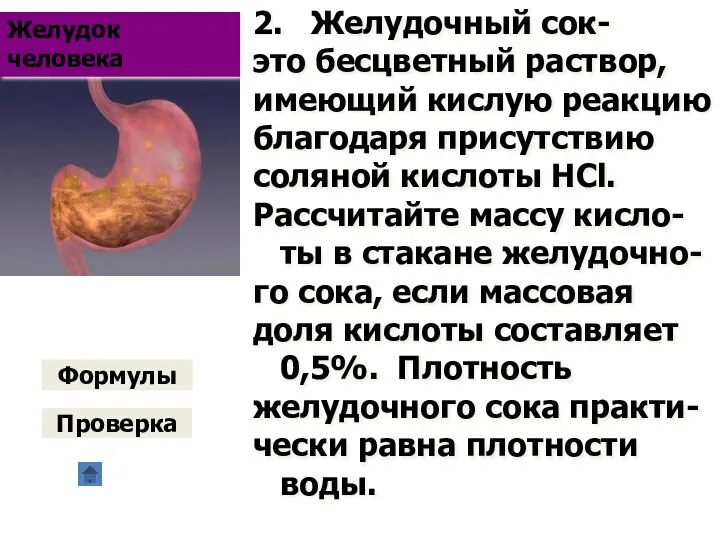
- 15. 2. Желудочный сок- это бесцветный раствор, имеющий кислую реакцию благодаря присутствию соляной кислоты HCl. Рассчитайте массу
- 16. 3. Для консервирования огурцов используют рассол, содержащий 7% поваренной соли и 3 % уксусной кислоты. Приготовьте
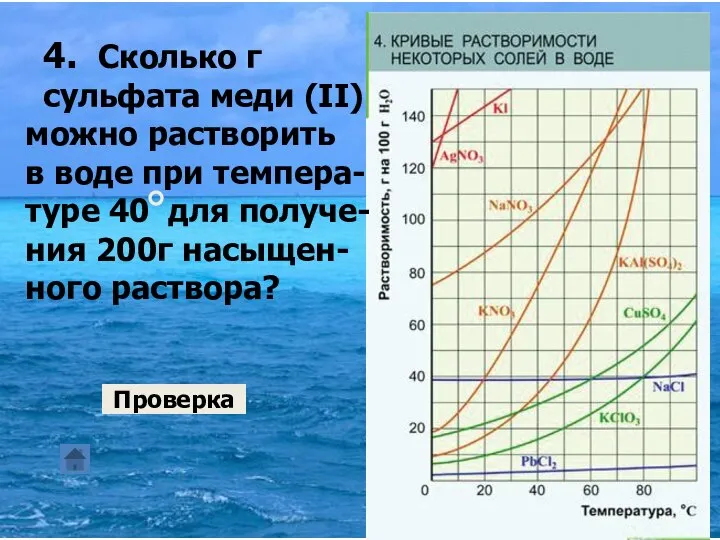
- 17. 4. Сколько г сульфата меди (II) можно растворить в воде при темпера- туре 40 для получе-
- 18. m(вещества) ω(вещества)= х 100% m(раствора) m(раствора)= m(вещества)+m(раст-ля) ρ=m/V, m = ρ х V К задаче
- 19. Задача 1 Допустим, Ваш вес составляет 60 кг. 60кг - 100% Х = 60х70/100=42 кг Х
- 20. Задача 4 При 40 С В 100г растворителя растворяется 29г CuSO4, т.о. m(раствора)=129г В 129г (раствора)
- 21. Задача 2 m (HCl) = m(раствора)х ω (HCl)/100% m (HCl) =0,5х200/100=1г Ответ: 1г. К задаче
- 23. Скачать презентацию












 Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Молибден. Получение молибдена
Молибден. Получение молибдена Металлы и их соединения
Металлы и их соединения Явления, происходящие с веществами
Явления, происходящие с веществами Идентификация С-конца ПП цепи
Идентификация С-конца ПП цепи Презентация на тему ОВР в органической химии 11 класс
Презентация на тему ОВР в органической химии 11 класс  Презентация на тему Аммиак состав, строение, свойства, применение
Презентация на тему Аммиак состав, строение, свойства, применение  Презентация по химии на тему _Высокомолекулярные Соединения_ (1)
Презентация по химии на тему _Высокомолекулярные Соединения_ (1) Расчет энтропии образования и теплоемкости органических веществ методом Бенсона
Расчет энтропии образования и теплоемкости органических веществ методом Бенсона ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ.
ДИЕНОВЫЕ УГЛЕВОДОРОДЫ. КАУЧУКИ. Введение в общую теорию поверхностных явлений. Лекция 1
Введение в общую теорию поверхностных явлений. Лекция 1 Про задачи. Химия 11 класс
Про задачи. Химия 11 класс Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Белый фосфор
Белый фосфор Шаблон презентации по химии
Шаблон презентации по химии Согласованное и несогласованное действие заместителей в бензольном кольце
Согласованное и несогласованное действие заместителей в бензольном кольце Химическая организация клетки. Неорганические вещества
Химическая организация клетки. Неорганические вещества Ароматические углеводороды. Бензол Презентация выполнена учителем химии лицея №1 пос. Львовский Подольского района Воробьёвой
Ароматические углеводороды. Бензол Презентация выполнена учителем химии лицея №1 пос. Львовский Подольского района Воробьёвой Классы неорганических веществ
Классы неорганических веществ Повторение по теме Химические реакции
Повторение по теме Химические реакции Гидролиз солей
Гидролиз солей Вуглеводи
Вуглеводи Презентация на тему Коррозия металлов (9 класс)
Презентация на тему Коррозия металлов (9 класс)  Гидролиз солей. 9 класс
Гидролиз солей. 9 класс Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Золоторудное поле Дуэт
Золоторудное поле Дуэт Лекция № 2. Синтез полимеров. Полимеризация
Лекция № 2. Синтез полимеров. Полимеризация