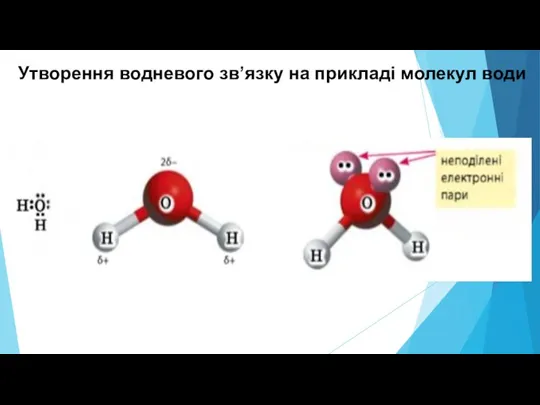
Слайд 3Утворення водневого зв’язку на прикладі молекул води
Слайд 4У молекулі води спільні електронні пари зміщені до більш електронегативного атому Оксигену.
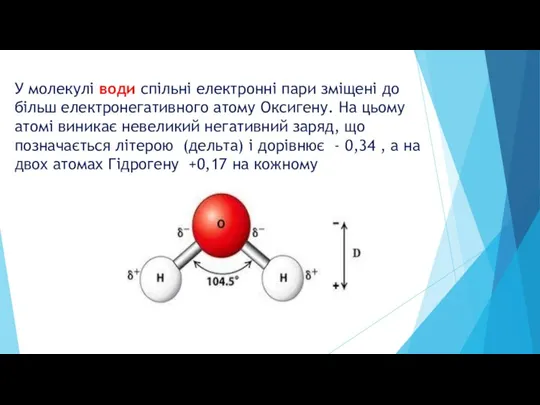
На цьому атомі виникає невеликий негативний заряд, що позначається літерою (дельта) і дорівнює - 0,34 , а на двох атомах Гідрогену +0,17 на кожному
Слайд 5Молекули води орієнтуються між собою так, щоб у контакті перебували їхні атоми
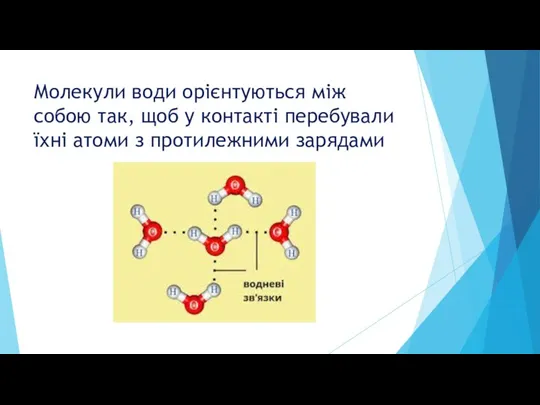
з протилежними зарядами
Слайд 6Водневий зв’язок – це електростатична взаємодія в молекулах або між ними за
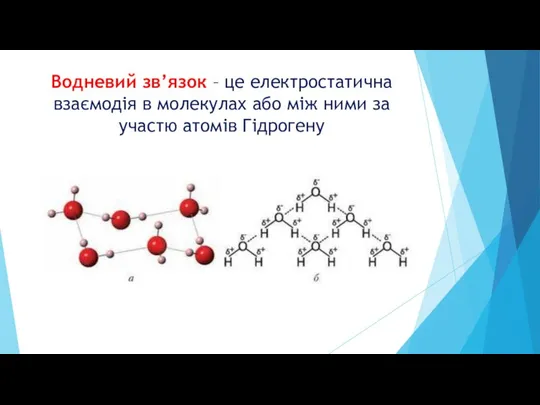
участю атомів Гідрогену
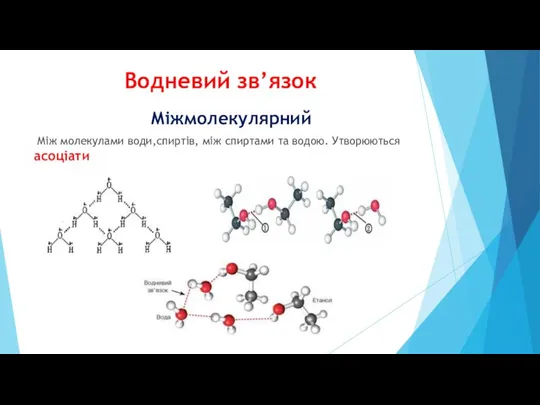
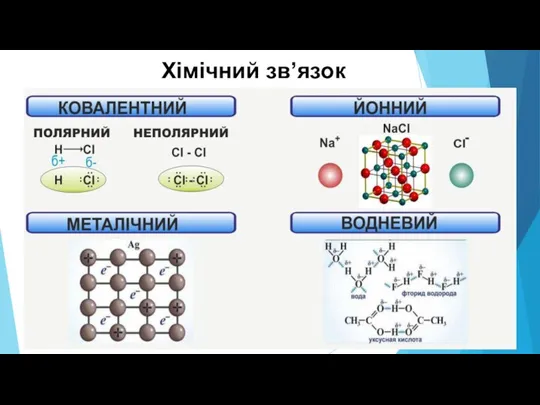
Слайд 7Водневий зв’язок
Міжмолекулярний
Між молекулами води,спиртів, між спиртами та водою. Утворюються асоціати
Слайд 8Водневий зв’язок
Внутрішньомолекулярний
В молекулах неорганічних та органічних сполук. В органічних сполуках на нього
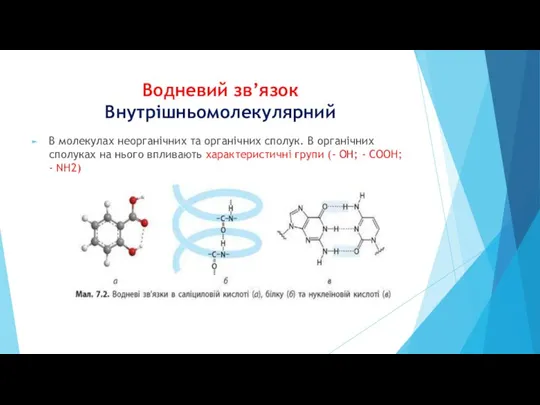
впливають характеристичні групи (- ОН; - СООН; - NH2)
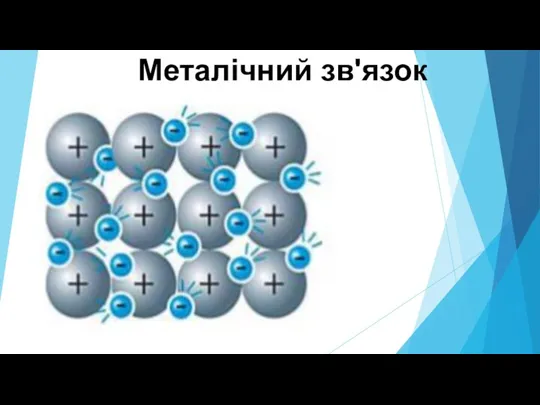
Слайд 10Металічний зв'язок – це особливий від звязку, що утворюється внаслідок взаємодії вільних
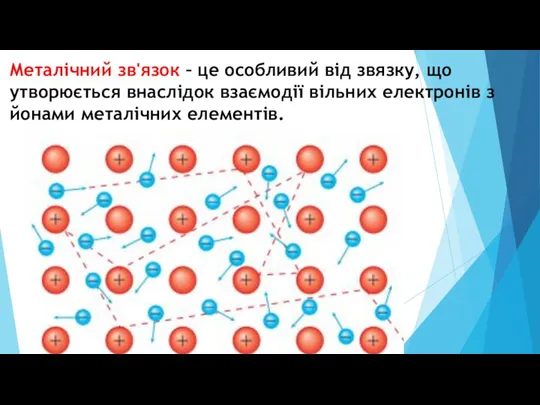
електронів з йонами металічних елементів.
Слайд 11У металах у вузлах кристалічних ґраток розташовані катіони металічних елементів, навколо яких

вільно пересуваються електрони
Слайд 12Порівняння металічного зв'язку з йонним
Подібно до йонного зв’язку, металічний утворюється завдяки електростатичному

притяганню протилежно заряджених частинок.
Але в речовинах із йонним зв’язком у вузлах кристалічних ґраток розташовані і позитивно, і негативно заряджені йони, що утримуються разом.
А в речовинах із металічним зв’язком у вузлах кристалічних ґраток розташовані тільки позитивно заряджені йони, що утримуються разом за рахунок електростатичного притягання до «електронного газу».
Слайд 13Порівняння металічного зв'язку з ковалентним
Подібно до ковалентного, металічний зв’язок утворюється за

рахунок усуспільнення електронів.
Але в ковалентному зв’язку спільною є тільки пара електронів, і вона належить лише двом атомам, а в металічному зв’язку всі електрони є спільними для всіх йонів металічного кристала.
Слайд 14Металічний зв’язок:
• у вузлах кристалічних ґраток розташовані катіони металічних елементів;
•

вільні електрони («електронний газ») утримують разом катіони;
• характерний для металів та їхніх сплавів
Слайд 15Схематичне зображення металічних кристалічних ґраток.
Атоми (1) металічного елемента та його катіони
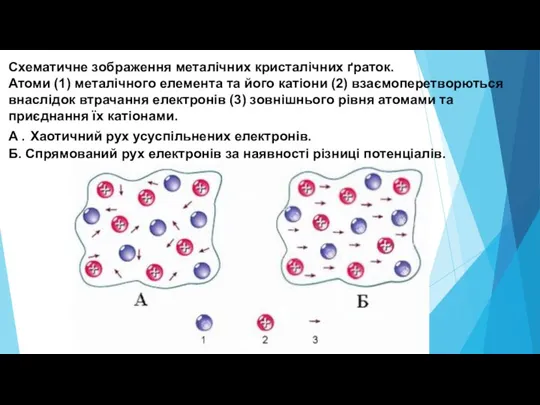
(2) взаємоперетворються внаслідок втрачання електронів (3) зовнішнього рівня атомами та приєднання їх катіонами.
А . Хаотичний рух усуспільнених електронів.
Б. Спрямований рух електронів за наявності різниці потенціалів.
Слайд 16Унаслідок удару чи іншого механічного впливу (1) відбувається зсув шарів йонів у
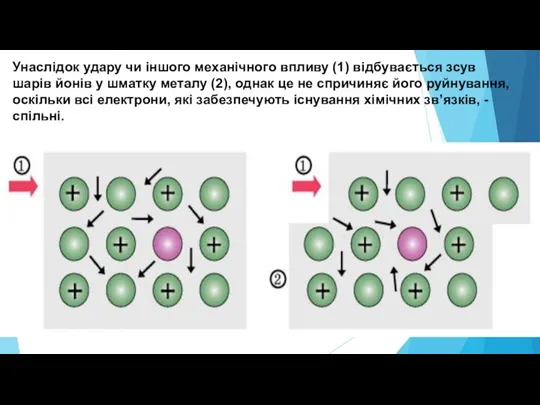
шматку металу (2), однак це не спричиняє його руйнування, оскільки всі електрони, які забезпечують існування хімічних зв’язків, - спільні.
Слайд 17Наявність вільних електронів, що можуть пересуватися в певному напрямку, зумовлює електропровідність речовин
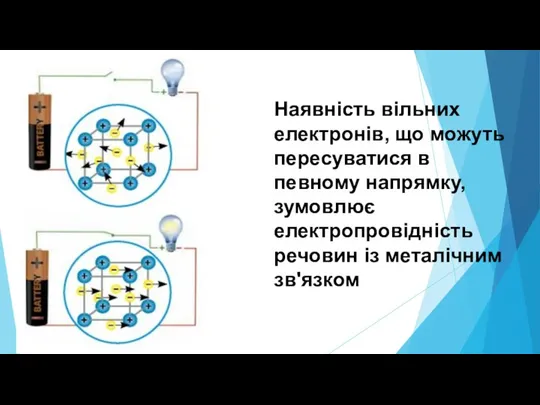
із металічним зв'язком
Слайд 18Вільні електрони, неначе тісто, скріплюють катіони металічних елементів незалежно від просторової форми
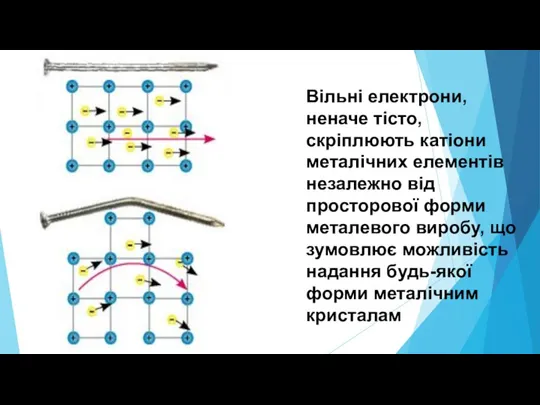
металевого виробу, що зумовлює можливість надання будь-якої форми металічним кристалам
Слайд 19Існування металічного зв’язку, тобто «електронного газу», здатного вільно пересуватися, зумовлює низку фізичних

властивостей речовин із таким зв’язком: електропровідність, гнучкість (ковкість або пластичність), металічний блиск, теплопровідність тощо.
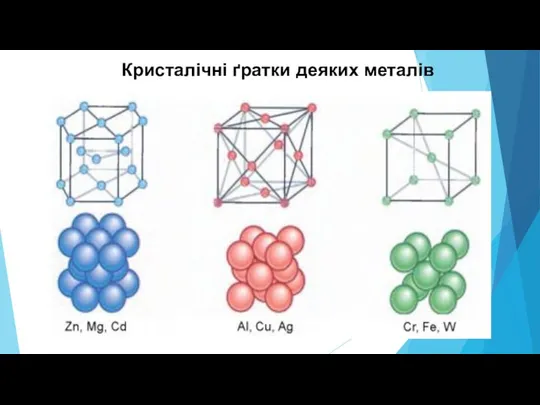
Слайд 20Кристалічні ґратки деяких металів

















 Приёмы работы с текстом на уроках химии
Приёмы работы с текстом на уроках химии Соли. Свойства. Получение
Соли. Свойства. Получение Неорганическая химия, часть 1
Неорганическая химия, часть 1 Вуглеводні. Метан як представник насичених вуглеводнів
Вуглеводні. Метан як представник насичених вуглеводнів Изомерия. Виды изомерии
Изомерия. Виды изомерии Фосфор
Фосфор Готовимся к ЕГЭ по органической химии Ароматические углеводороды
Готовимся к ЕГЭ по органической химии Ароматические углеводороды Кислоты
Кислоты Природный газ. 10 класс
Природный газ. 10 класс Chemické reakcie
Chemické reakcie Фепромарон. Химическое название
Фепромарон. Химическое название Классификация и номенклатура аминов. 11 класс
Классификация и номенклатура аминов. 11 класс Пайданалылған майларды қолдана отырып көмірді брикеттер алу
Пайданалылған майларды қолдана отырып көмірді брикеттер алу Презентация на тему Классификация химических реакций 11 класс
Презентация на тему Классификация химических реакций 11 класс  Презентация на тему Уголь
Презентация на тему Уголь  Растворы. 11 класс
Растворы. 11 класс Основания, состав и классификация
Основания, состав и классификация Металлы. Общие свойства
Металлы. Общие свойства Консистентные смазки для легковых автомобилей
Консистентные смазки для легковых автомобилей Химические реакции. Классификация
Химические реакции. Классификация Получение и химические свойства металлов
Получение и химические свойства металлов Практикум по химии и технологии нефти и газа
Практикум по химии и технологии нефти и газа Химическая термодинамика. Экзаменационные вопросы
Химическая термодинамика. Экзаменационные вопросы Биологическое окисление
Биологическое окисление Алкины
Алкины 10_Valentnost_khimicheskikh_elementov
10_Valentnost_khimicheskikh_elementov Кислоты 9 класс
Кислоты 9 класс Электрохимические процессы
Электрохимические процессы