Содержание
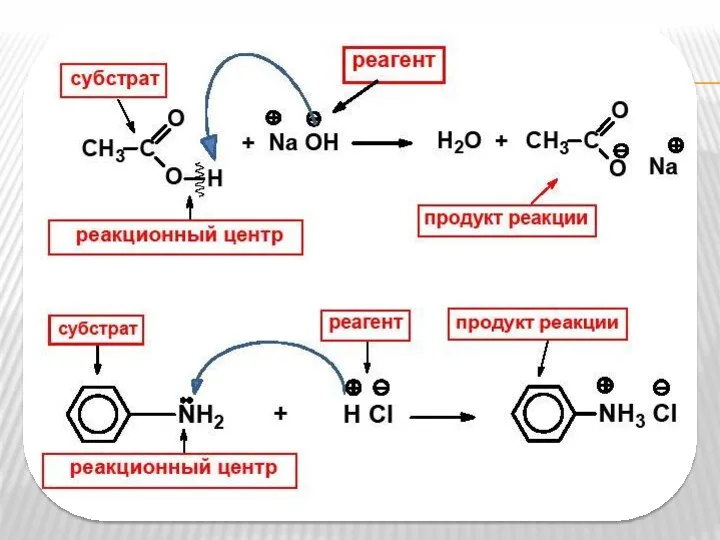
- 2. Основные определения Реакционная способность - способность вещества вступать в ту или иную химическую реакцию и реагировать
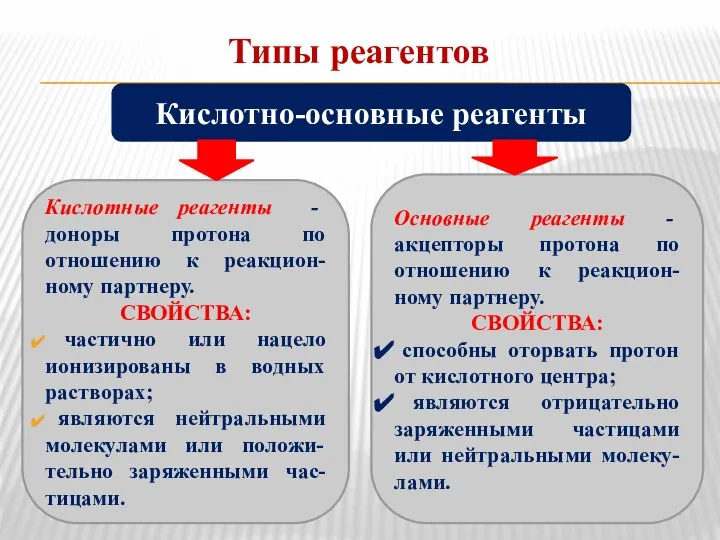
- 4. Типы реагентов Кислотные реагенты - доноры протона по отношению к реакцион-ному партнеру. СВОЙСТВА: частично или нацело
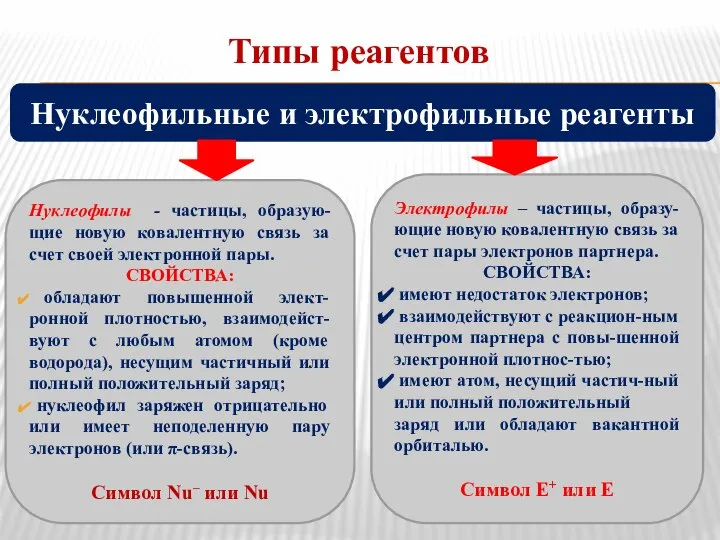
- 5. Типы реагентов Нуклеофилы - частицы, образую-щие новую ковалентную связь за счет своей электронной пары. СВОЙСТВА: обладают
- 6. Типы реагентов Радикалы - свободные атомы или частицы с неспаренным электроном. Символ R Окислители - нейтральные
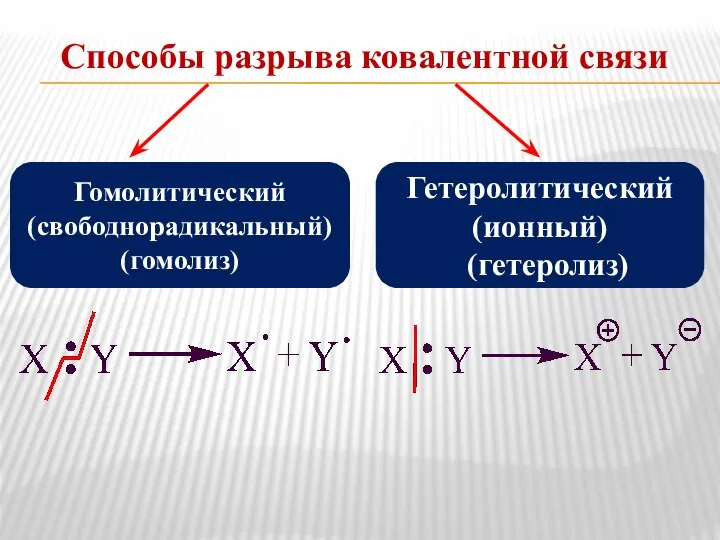
- 7. Способы разрыва ковалентной связи Гомолитический (свободнорадикальный) (гомолиз) Гетеролитический (ионный) (гетеролиз)
- 8. Признаки классификации органических реакций по характеру изменения связей в субстрате и реагенте; по типу реагента; по
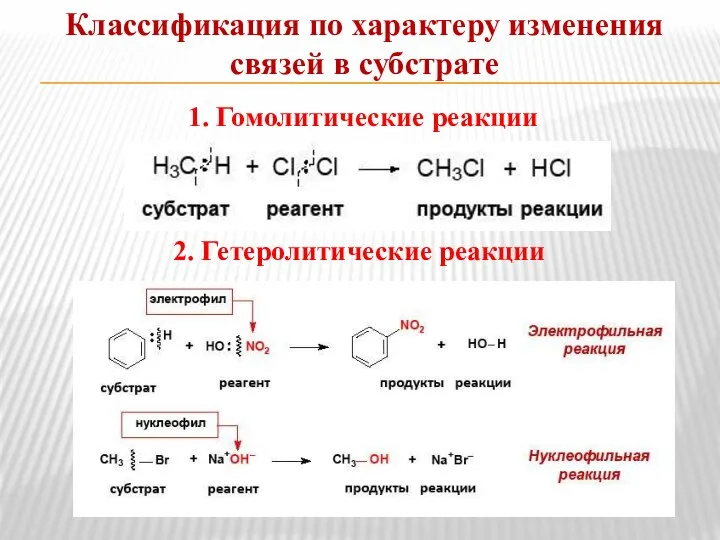
- 9. Классификация по характеру изменения связей в субстрате 1. Гомолитические реакции 2. Гетеролитические реакции
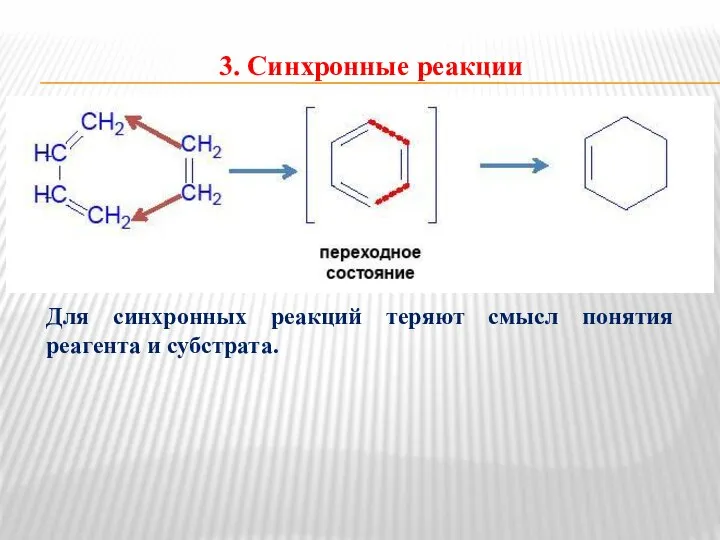
- 10. 3. Синхронные реакции Для синхронных реакций теряют смысл понятия реагента и субстрата.
- 11. Классификация по типу реагента Радикальные (R) Электрофильные (E) Нуклеофильные (N) Окислительные [O] Восстановительные [H]
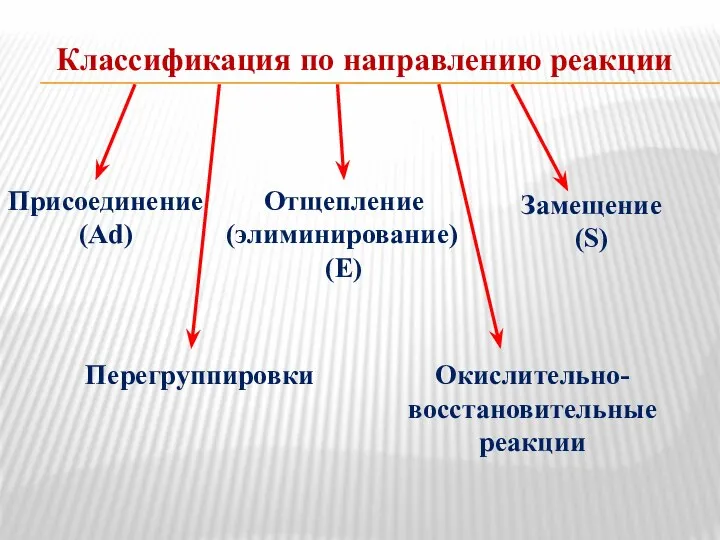
- 12. Классификация по направлению реакции Присоединение (Ad) Отщепление (элиминирование) (E) Замещение (S) Перегруппировки Окислительно- восстановительные реакции
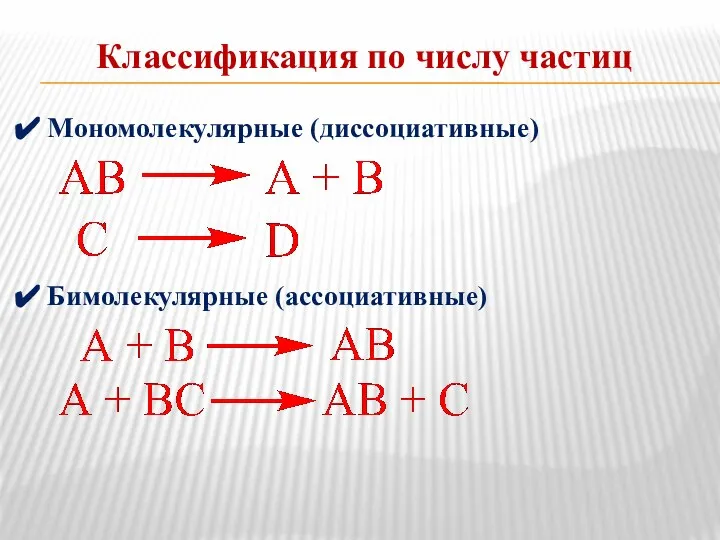
- 13. Классификация по числу частиц Мономолекулярные (диссоциативные) Бимолекулярные (ассоциативные)
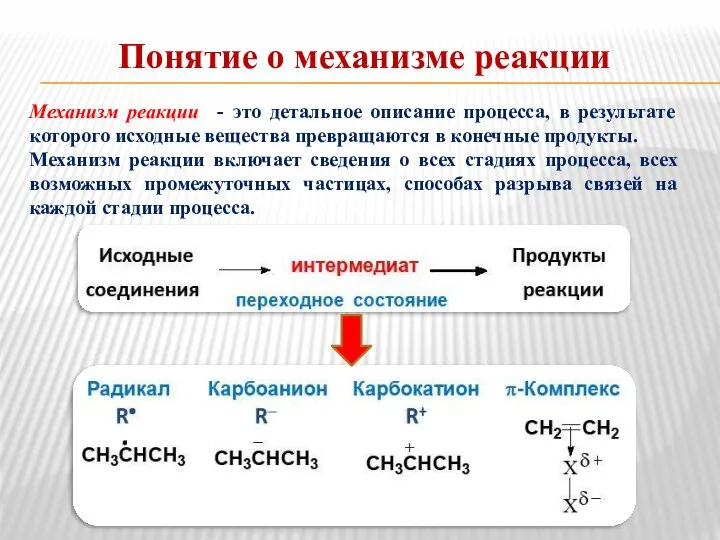
- 14. Понятие о механизме реакции Механизм реакции - это детальное описание процесса, в результате которого исходные вещества
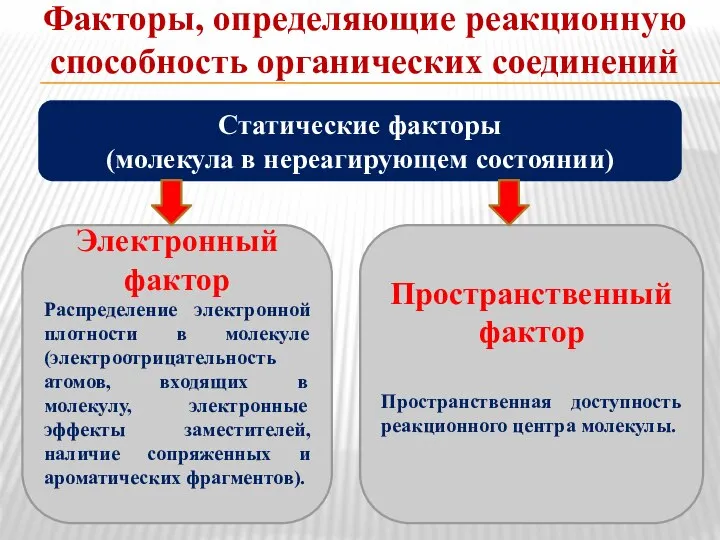
- 15. Факторы, определяющие реакционную способность органических соединений Статические факторы (молекула в нереагирующем состоянии) Электронный фактор Распределение электронной
- 16. Включают оценку энергии промежуточных частиц или переходного состояния. Чем больше возможностей для делокализации (рассредоточения) электронной плотности
- 18. Скачать презентацию



![Классификация по типу реагента Радикальные (R) Электрофильные (E) Нуклеофильные (N) Окислительные [O] Восстановительные [H]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1085730/slide-10.jpg)

 Способы получения чистых веществ в лаборатории
Способы получения чистых веществ в лаборатории Плотность вещества
Плотность вещества Алкадиены. Физические свойства
Алкадиены. Физические свойства Разбор контрольной работы. Химия (9 класс)
Разбор контрольной работы. Химия (9 класс) Растворы электролитов (окончание)
Растворы электролитов (окончание) Фосфаттардағы байланыс теориясы
Фосфаттардағы байланыс теориясы Ионные уравнения реакций
Ионные уравнения реакций Презентация на тему Классы неорганических веществ
Презентация на тему Классы неорганических веществ  Благородный металл платина
Благородный металл платина Экстракционное разделение радионуклидов
Экстракционное разделение радионуклидов Презентация на тему Альдегиды и их свойства
Презентация на тему Альдегиды и их свойства  Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол
Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений
Потенциодинамическая электрохимическая наногравиметрия теллура и его соединений Химико-аналитический контроль
Химико-аналитический контроль Цветные реакции белков
Цветные реакции белков Хімічна промисловість
Хімічна промисловість Электролитическая диссоциация
Электролитическая диссоциация Мономеры
Мономеры Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9
Электрокинетические явления. Электрофорез. Макро- и микроэлектрофорез. Лекция 9 Основания. 8 класс
Основания. 8 класс Ферсман Александр Евгеньевич Очарованный камнем
Ферсман Александр Евгеньевич Очарованный камнем Коррозия металлов, сплавов
Коррозия металлов, сплавов Строение атома
Строение атома Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Составление ионных уравнений
Составление ионных уравнений Алкоголь и мозг
Алкоголь и мозг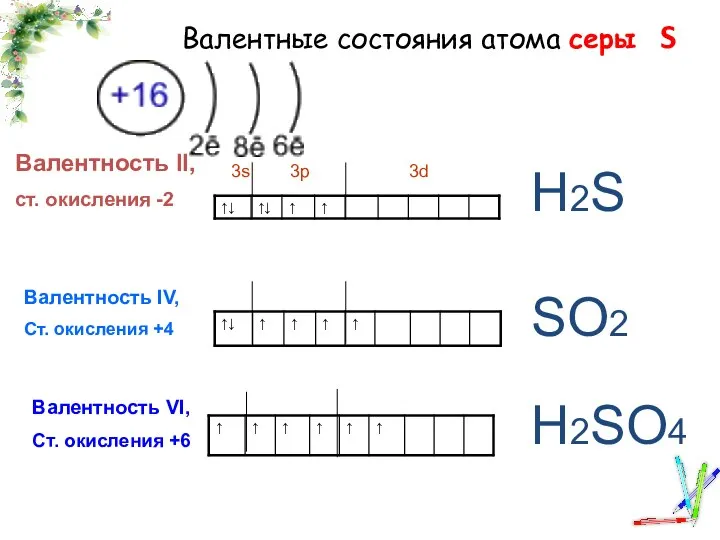 Валентные состояния атома серы
Валентные состояния атома серы Классификация химических реакций
Классификация химических реакций