Содержание
- 2. Производство аммиака. Экологические последствия производства аммиака
- 3. Цели обучения
- 4. Критерии оценивания Пишет уравнения реакции получения аммиака в промышленности Называет условия получения аммиака Перечисляет области применения
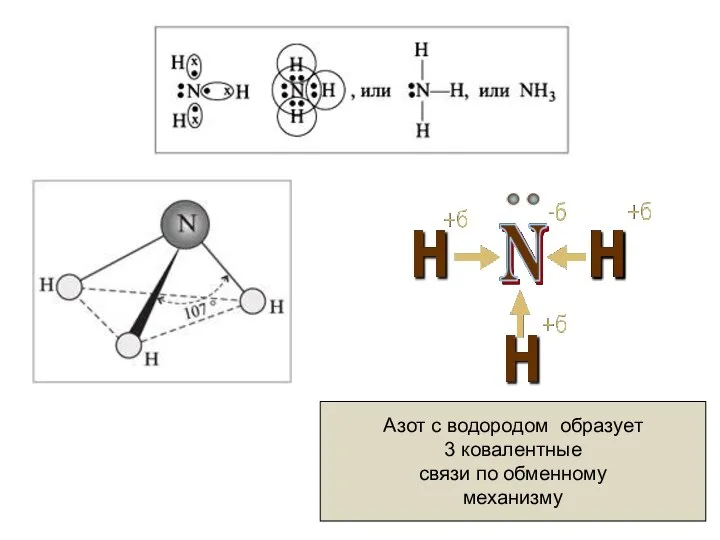
- 5. Азот с водородом образует 3 ковалентные связи по обменному механизму
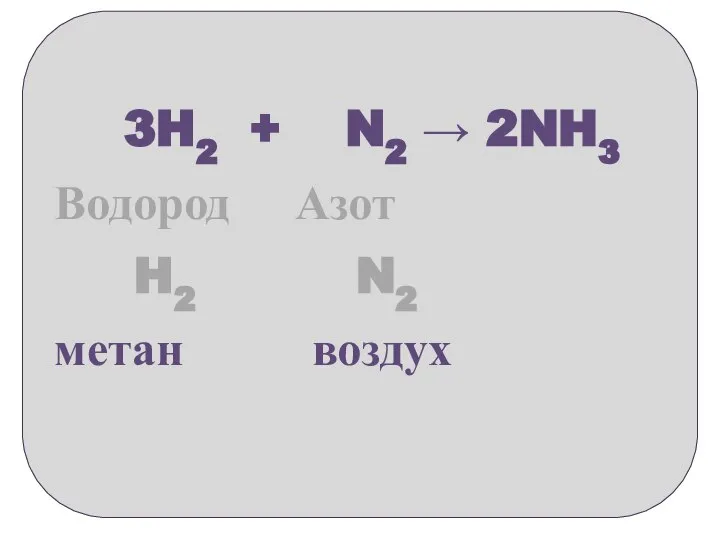
- 6. Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N2(г) + 3H2(г) ↔ 2NH3(г)
- 7. Азот, выделяемый из воздуха Водород, получаемый взаимодействием метана с водяным паром: СН4+Н2О→СО+3Н2 Условия реакции: 750 °С,
- 8. 3H2 + N2 → 2NH3 Водород Азот H2 N2 метан воздух
- 9. Подготовка сырья и подвод реагирующих веществ в зону реакции Химические процессы Отвод продуктов и не прореагировавших
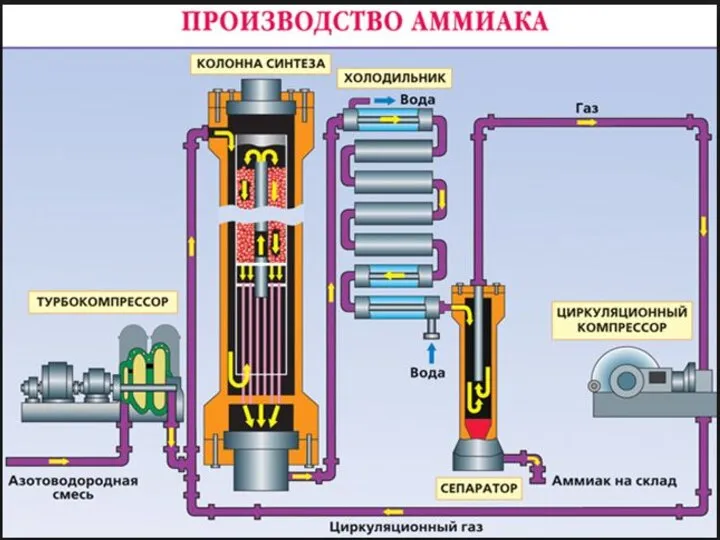
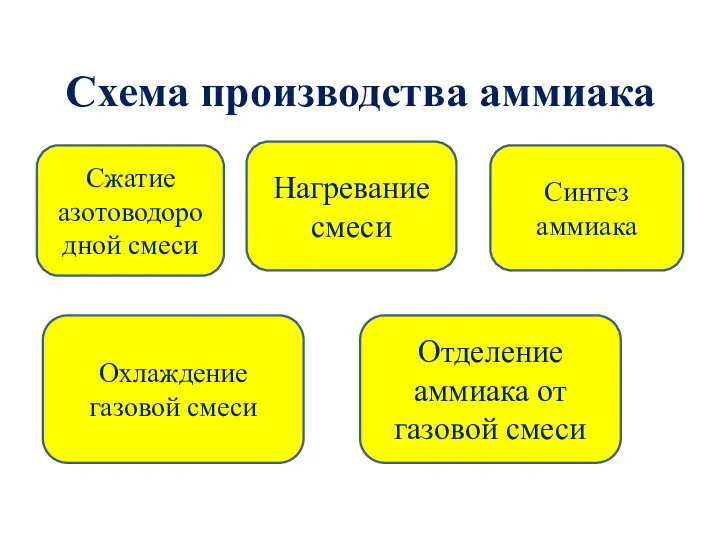
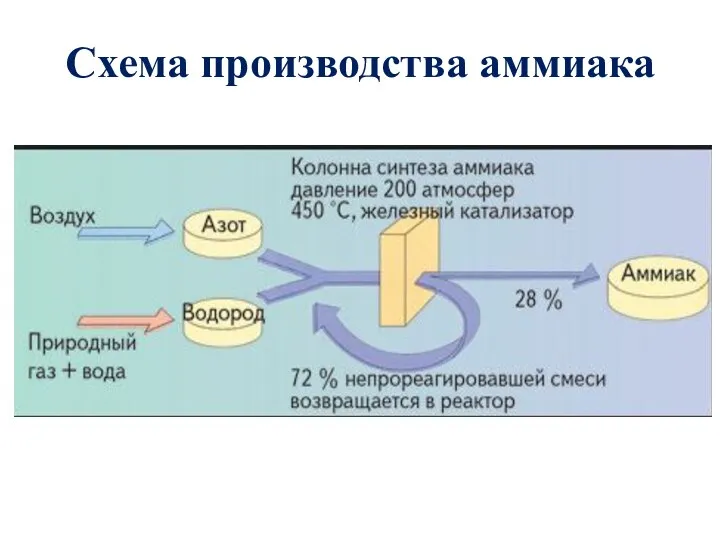
- 11. Схема производства аммиака Сжатие азотоводородной смеси Нагревание смеси Синтез аммиака Охлаждение газовой смеси Отделение аммиака от
- 12. Схема производства аммиака
- 13. Реакция синтеза аммиака экзотермическая, обратимая, каталитическая N2+3H2 ↔ 2NH3+92кДж Объем вводимого воздуха такой, чтобы соотношение азота
- 14. Какие необходимо создать условия, чтобы выход аммиака был максимальным?
- 15. Влияние температуры Выход аммиака увеличится, если реакцию проводить при оптимальной температуре 400-500°С
- 16. Влияние давления Чем выше давление, тем больше выход аммиака, т.к. из четырех молей исходных веществ образуется
- 17. Дополнительными условиями служат увеличение концентрации продуктов реакции Газовая смесь, содержащая метан, инертные газы воздуха, угарный газ
- 18. Дифференциация Для всех: 1.При производстве аммиака получено 230 л продукта. Сколько это составляет от теоретически возможного,
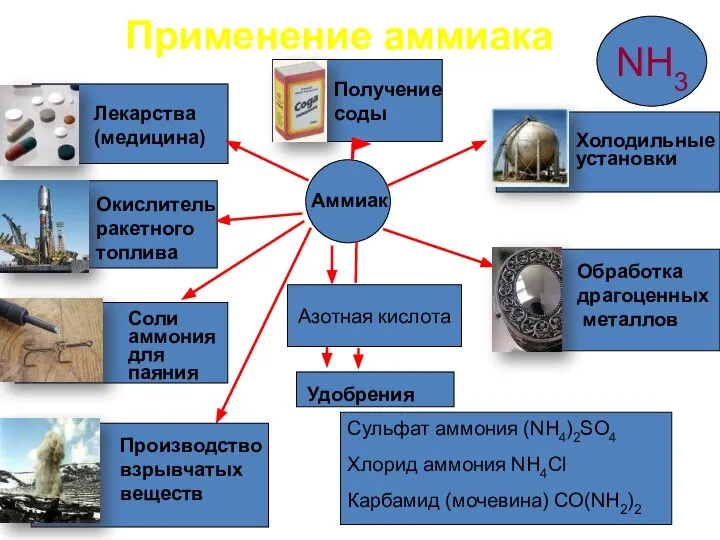
- 19. Азотная кислота Сульфат аммония (NH4)2SO4 Хлорид аммония NH4Cl Карбамид (мочевина) CO(NH2)2 Аммиак Удобрения Лекарства (медицина) Окислитель
- 20. Техногенные катастрофы
- 21. Основные экологические проблемы Современное производство аммиака основано на практически безотходной технологии с минимальными выбросами. Основными проблемами
- 23. Скачать презентацию














 Аналитические методы в современных исследованиях химии
Аналитические методы в современных исследованиях химии Презентация на тему Химия и повседневная жизнь человека
Презентация на тему Химия и повседневная жизнь человека  Вуглеводи. Визначення вуглеводів
Вуглеводи. Визначення вуглеводів Химическая связь
Химическая связь Химические реакции
Химические реакции Полиуретановые полимеры
Полиуретановые полимеры Валентность. Определение валентности химических элементов по формуле вещества
Валентность. Определение валентности химических элементов по формуле вещества Презентация на тему Аммиак
Презентация на тему Аммиак  Производство нитрата аммония (лекция 16)
Производство нитрата аммония (лекция 16) Физико - химические основы получения лекарственных препаратов (лекция 4)
Физико - химические основы получения лекарственных препаратов (лекция 4) Строение атома
Строение атома Алкины
Алкины Электронная структура атома углерода. Лекция 3
Электронная структура атома углерода. Лекция 3 Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Полиэтилен-1
Полиэтилен-1 Строение органических молекул. (Лекция 2)
Строение органических молекул. (Лекция 2) Нефть. Её состав. Термический и каталитический крекинг
Нефть. Её состав. Термический и каталитический крекинг Углерод
Углерод Спирты. Непредельные спирты
Спирты. Непредельные спирты Окисление этанола оксидом меди
Окисление этанола оксидом меди Гідроліз солей
Гідроліз солей Изотопная геохимия. Лекция 4-5
Изотопная геохимия. Лекция 4-5 Элементоорганические мономеры (соединения)
Элементоорганические мономеры (соединения) Относительная атомная масса. Массы атомов
Относительная атомная масса. Массы атомов Выращивание кристаллов
Выращивание кристаллов Классификация спиртов. Изомерия спиртов
Классификация спиртов. Изомерия спиртов Кремний и его соединения. Силикатная промышленность
Кремний и его соединения. Силикатная промышленность Характеристика химического элемента по его положению в периодической системе элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д.И. Менделеева