Слайд 2Спирты
Спирты — органические соединения, содержащие одну или более гидроксильных групп (гидроксил, −OH), непосредственно связанных с насыщенным (находящимся
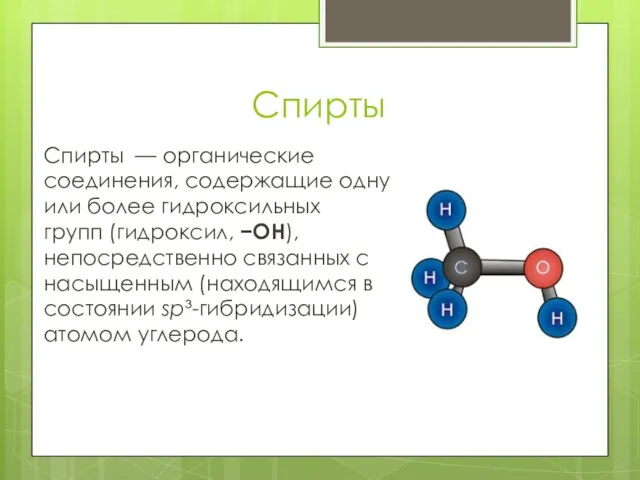
в состоянии sp³-гибридизации) атомом углерода.
Слайд 3Классификация спиртов
По числу гидроксильных групп:
Одноатомные
двухатомные (гликоли)
трёхатомные

Слайд 4По характеру углеводородного радикала:
предельные спирты
непредельные (имеют кратные связи)спирты
ароматические спирты

Слайд 5Номенклатура
По номенклатуре ИЮПАК названия простых спиртов образуются от названий соответствующих алканов с добавлением суффикса «-ол», положение которого

указывается арабской цифрой.
Слайд 6Изомерия
Начиная с 3 гомологического ряда появляется изомерия положения функциональной группы (пропанол-1 и

пропанол-2), а ч 4 – изомерия углеродного скелета.
Межклассовая с простыми эфирами
Слайд 7Физические свойства
Молекулы спиртов, подобно молекуле воды, имеют угловое строение. Угол R−O−H в молекуле метанола равен
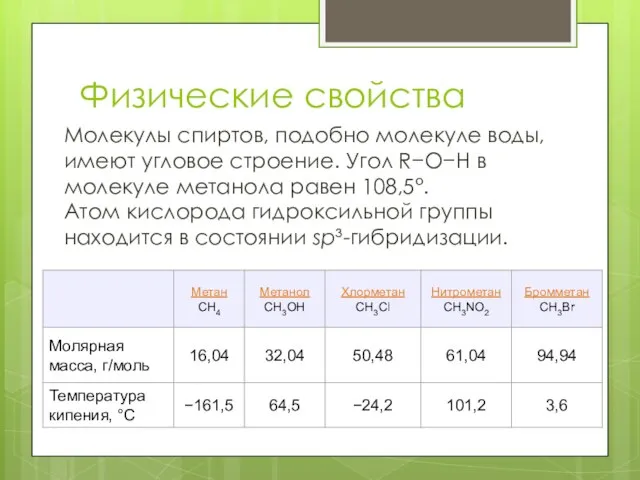
108,5°. Атом кислорода гидроксильной группы находится в состоянии sp³-гибридизации.
Слайд 8Химические свойства
Реакции, протекающие по связи О–Н.
При взаимодействии с активными металлами (Na, K,

Mg, Al) спирты проявляют свойства слабых кислот и образуют соли, называемые алкоголятами или алкоксидами:
2CH3OH + 2Na → 2CH3OK + H2
Алкоголяты химически не стабильны и при действии воды гидролизуются с образованием спирта и гидроксида металла:
C2H5OК + H2O → C2H5OH + КOH
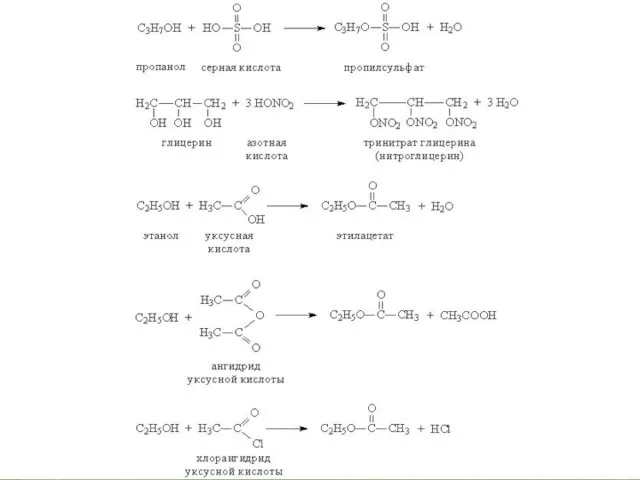
Слайд 9При взаимодействии с минеральными или органическими кислотами спирты образуют сложные эфиры –

соединения, содержащие фрагмент R–O–A (А – остаток кислоты). Образование сложных эфиров происходит и при взаимодействии спиртов с ангидридами и хлорангидридами карбоновых кислот
Слайд 11При действии окислителей (К2Cr2O7, KMnO4) первичные спирты образуют альдегиды, а вторичные – кетоны.

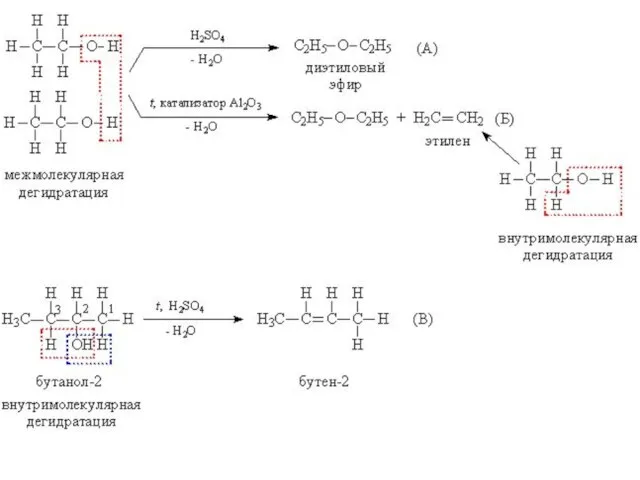
Слайд 12В присутствии катализаторов или сильных минеральных кислот происходит дегидратация спиртов (отщепление воды),

при этом реакция может идти в двух направлениях:
а) межмолекулярная дегидратация с участием двух молекул спирта, при этом связи С–О у одной из молекул разрываются, в результате образуются простые эфиры – соединения, содержащие фрагмент R–О–R.
б) при внутримолекулярной дегидратации образуются алкены - углеводороды с двойной связью. Часто оба процесса – образование простого эфира и алкена – протекают параллельно.
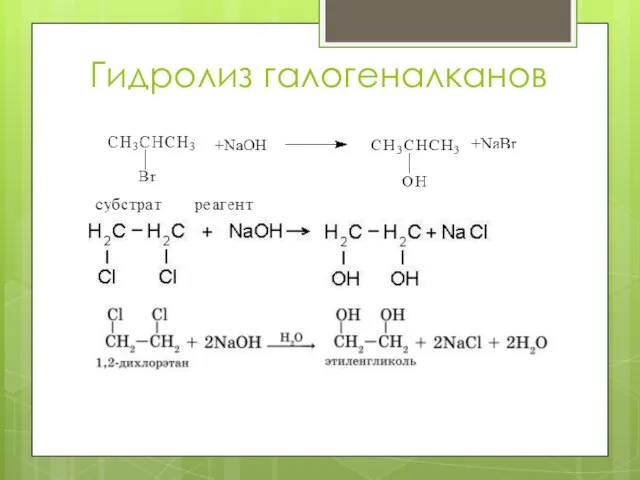
Слайд 14Взаимодействие спиртов с галогеноводородами

Слайд 15Получение спиртов
Гидратация алкенов (правило Марковникова):
Алкены присоединяют воду в кислой среде по механизму электрофильного

присоединения, по правилу Марковникова.
Слайд 17Гидрирование альдегидов и кетонов
(при воздействии температуры и платинового катализатора)















 Получение и применение алкадиенов
Получение и применение алкадиенов Проект в сфере экологического волонтерства преподавателя химии первой квалификационной категории
Проект в сфере экологического волонтерства преподавателя химии первой квалификационной категории Теоретические основы органической химии. Лекция 25
Теоретические основы органической химии. Лекция 25 Соли азотной кислоты – нитраты. Нитриты, Азотные удобрения
Соли азотной кислоты – нитраты. Нитриты, Азотные удобрения Относительная атомная и молекулярная масса
Относительная атомная и молекулярная масса Вклад учёных-химиков в Великую победу
Вклад учёных-химиков в Великую победу Презентация на тему Генетическая связь между классами неорганических вещ-в
Презентация на тему Генетическая связь между классами неорганических вещ-в  Типы кристаллических структур Автор Могилевская А.Е. Санкт-Петербург. ГБОУ СОШ№535
Типы кристаллических структур Автор Могилевская А.Е. Санкт-Петербург. ГБОУ СОШ№535 Основания и кислоты в повседневной жизни
Основания и кислоты в повседневной жизни Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Агрегатные состояния веществ
Агрегатные состояния веществ Путешествие в страну Металлию. Тест по химии
Путешествие в страну Металлию. Тест по химии Валентность (от латинского valentia – сила)
Валентность (от латинского valentia – сила) 8_ANIONY_2_3_angr
8_ANIONY_2_3_angr h-m-chniy-zv-yazok-budova-rechovin
h-m-chniy-zv-yazok-budova-rechovin Химическое равновесие. Задачи
Химическое равновесие. Задачи Разбор задач
Разбор задач Алкадиены, каучуки
Алкадиены, каучуки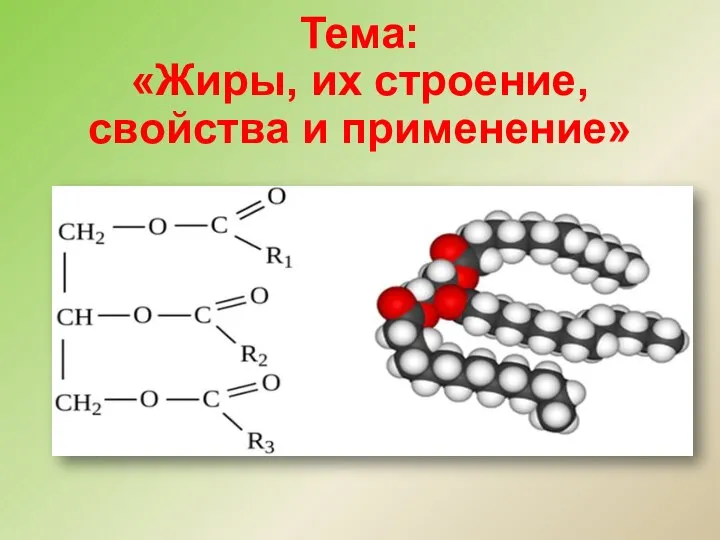 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Классификация оксидов
Классификация оксидов Щелочные металлы
Щелочные металлы Закон Гесса. Термохимические уравнения
Закон Гесса. Термохимические уравнения Комплексные соединения
Комплексные соединения Презентация на тему Растворы (11 класс)
Презентация на тему Растворы (11 класс)  Введение в органическую химию
Введение в органическую химию Арены
Арены Составление формул солей
Составление формул солей Молярный объем газов
Молярный объем газов