Содержание
- 2. Серная кислота H2SO4 — сильная двухосновная кислота. При обычных условиях концентрированная серная кислота — тяжёлая маслянистая
- 3. Ее используют как гигроскопическое средство во многих химических реакциях, особенно при получении органических веществ, для осушки
- 4. Кроме того, благодаря этой способности, концентрированная серная кислота обугливает органические вещества (сахар, древесину), вызывает сильные ожоги
- 6. Свойства разбавленной серной кислоты Разбавленная H2SO4 - вступает в реакции замещения, за счет окисления катионов Н+:
- 7. Качественной реакцией на серную кислоту и её растворимые соли является их взаимодействие с растворимыми солями бария,
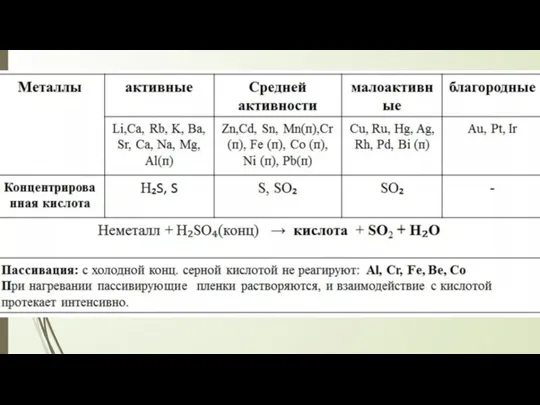
- 8. Свойства концентрированной серной кислоты Al, Cr, Fe пассивируются в конц.H2SO4, но реагируют с ней при нагревании:
- 10. Взаимодействие серной кислоты с неметаллами Взаимодействие серной кислоты с неметаллами происходит с выделением SO2 и окислением
- 11. Производство серной кислоты Видео - https://www.youtube.com/watch?v=uHtmnGjSTNE
- 13. Общие научные принципы химического производства: Непрерывность. Противоток Катализ Увеличение площади соприкосновения реагирующих веществ. Теплообмен Рациональное использование
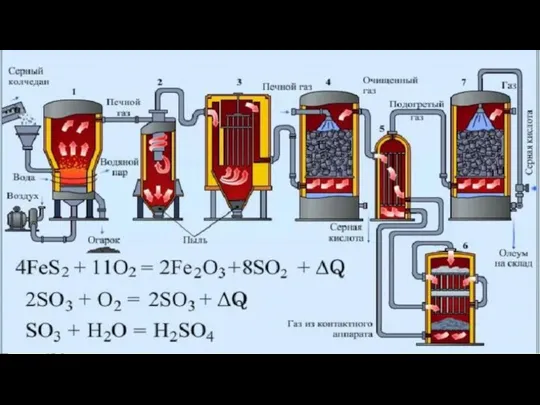
- 14. 1. Печь для обжига «в кипящем слое»: Пирит подвергают обжигу кислородом воздуха 4FeS2 + 11 O2
- 15. 6. Контактный аппарат: Обжиговый газ в присутствии катализатора при 450 °С окисляется до оксида серы (VI)
- 16. Экологические проблемы: Производство серной кислоты создает немало экологических проблем – на I стадии это потери сырья
- 18. Скачать презентацию













 Термохимические уравнения
Термохимические уравнения Углеводы, 2 часть. Лекция 15
Углеводы, 2 часть. Лекция 15 Многообразие веществ
Многообразие веществ Физические и фазовые состояния полимеров
Физические и фазовые состояния полимеров Химическое равновесие
Химическое равновесие Диагностическое тестирование по химии в 8 классе
Диагностическое тестирование по химии в 8 классе Карбоновые кислоты, их строение, номенклатура, получение и свойства
Карбоновые кислоты, их строение, номенклатура, получение и свойства Празеодим
Празеодим Угольная кислота и её соли
Угольная кислота и её соли Амины. Общие формулы аминов
Амины. Общие формулы аминов Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Закон эквивалентов
Закон эквивалентов Коррозия металлов. Способы защиты от коррозии
Коррозия металлов. Способы защиты от коррозии Презентация на тему Выбирай вопрос и отвечай
Презентация на тему Выбирай вопрос и отвечай  Физико-математические основы химии: Количество вещества, Молярная масса, Молярный объём, Число Авогадро
Физико-математические основы химии: Количество вещества, Молярная масса, Молярный объём, Число Авогадро Презентация на тему Химические вещества: строительные и поделочные материалы
Презентация на тему Химические вещества: строительные и поделочные материалы  Органическая химия. Введение
Органическая химия. Введение Минеральные компоненты молока и молочных продуктов. Макроэлементы
Минеральные компоненты молока и молочных продуктов. Макроэлементы Кислород и озон
Кислород и озон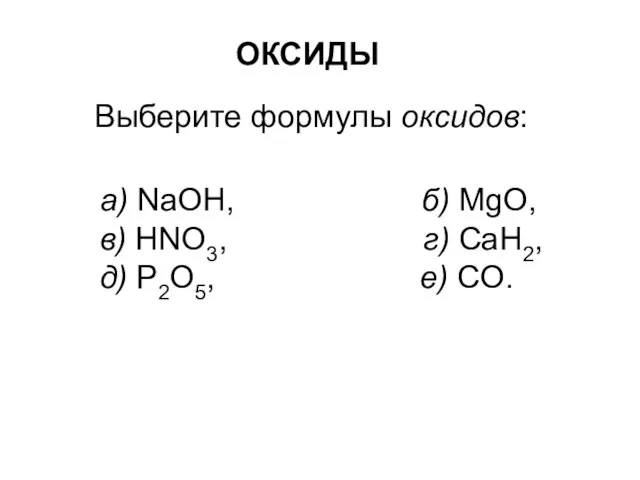 Оксиды
Оксиды Способы разделения нефти. Ректификация
Способы разделения нефти. Ректификация Композитные материалы
Композитные материалы Химическая шкатулка
Химическая шкатулка a319f492a6071afff03d7efc722c906b
a319f492a6071afff03d7efc722c906b Стереоизомерия
Стереоизомерия Строение вещества. Химическая связь
Строение вещества. Химическая связь Технология получения красного фосфора
Технология получения красного фосфора Химия и искусство: техника офорт
Химия и искусство: техника офорт