Содержание
Слайд 17Изображение реакций ионного обмена
Реакцию обмена в растворе можно выразить тремя видами уравнений:
Изображение реакций ионного обмена
Реакцию обмена в растворе можно выразить тремя видами уравнений:

молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
1. Запишем уравнение реакции в молекулярной форме:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
2. Перепишем это уравнение, изобразив хорошо диссоциирующие вещества в виде ионов:
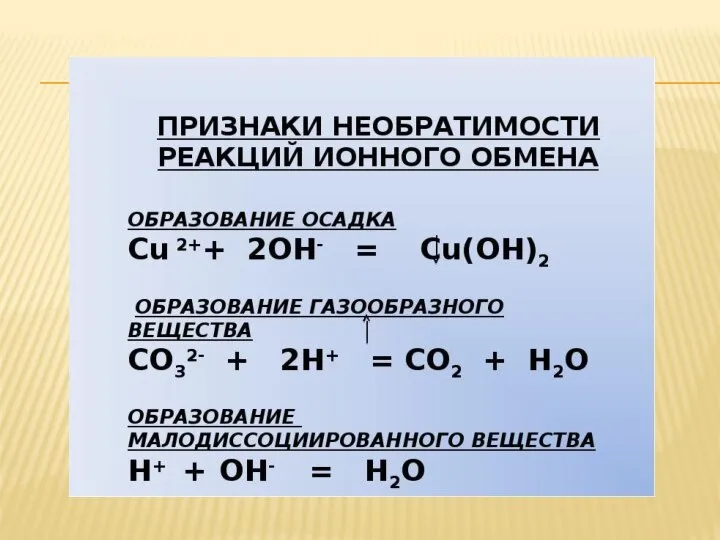
FeЗ + + 3Cl— + 3Nа+ + 3ОН— = Fе(ОН)3↓ + 3Nа+ + 3Cl— это ионное уравнение реакции.
3. Исключим из обеих частей ионного уравнения одинаковые ионы, т.е. ионы, не участвующие в реакции (они подчеркнуты):
Fe3+ + 3Cl— + 3Na— + 3ОН— = Fе(ОН)3↓ + 3Na++ 3Cl—.
4. Запишем уравнение реакции в окончательном виде:
Fe3 + + 3ОН— = Fe(OH)3↓ - это сокращенное ионное уравнение реакции. Как видно из этого уравнения, сущность реакции сводится к взаимодействию ионов Fe3+ и ОН—, в результате чего образуется осадок Fе(ОН)3. При этом вовсе не имеет значения, в состав каких электролитов входили эти ионы до их взаимодействия.
1. Запишем уравнение реакции в молекулярной форме:
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
2. Перепишем это уравнение, изобразив хорошо диссоциирующие вещества в виде ионов:
FeЗ + + 3Cl— + 3Nа+ + 3ОН— = Fе(ОН)3↓ + 3Nа+ + 3Cl— это ионное уравнение реакции.
3. Исключим из обеих частей ионного уравнения одинаковые ионы, т.е. ионы, не участвующие в реакции (они подчеркнуты):
Fe3+ + 3Cl— + 3Na— + 3ОН— = Fе(ОН)3↓ + 3Na++ 3Cl—.
4. Запишем уравнение реакции в окончательном виде:
Fe3 + + 3ОН— = Fe(OH)3↓ - это сокращенное ионное уравнение реакции. Как видно из этого уравнения, сущность реакции сводится к взаимодействию ионов Fe3+ и ОН—, в результате чего образуется осадок Fе(ОН)3. При этом вовсе не имеет значения, в состав каких электролитов входили эти ионы до их взаимодействия.

















 Получение пластмасс
Получение пластмасс Презентация на тему Типы химических реакций
Презентация на тему Типы химических реакций  Железо и его соединения
Железо и его соединения Щелочноземельные металлы
Щелочноземельные металлы Сера и её соединения
Сера и её соединения Презентация на тему Индикаторы
Презентация на тему Индикаторы  Реакции ионного обмена
Реакции ионного обмена Химическое равновесие в растворах электролитов
Химическое равновесие в растворах электролитов Презентация на тему Классификация органических веществ
Презентация на тему Классификация органических веществ  Практическая работа: Очистка загрязнённой поваренной соли
Практическая работа: Очистка загрязнённой поваренной соли Нуклеиновые кислоты
Нуклеиновые кислоты Презентация на тему Славный путь М.В. Ломоносова
Презентация на тему Славный путь М.В. Ломоносова  Решение задач повышенной сложности. 10 класс
Решение задач повышенной сложности. 10 класс Воздействие нейропептидов семакс и PGP на содержание транскриптов гена в головном мозге крыс в условиях экспериментальной ишемии
Воздействие нейропептидов семакс и PGP на содержание транскриптов гена в головном мозге крыс в условиях экспериментальной ишемии Звездный час. Конкурс химиков
Звездный час. Конкурс химиков Алмашу реакциясе
Алмашу реакциясе Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов" 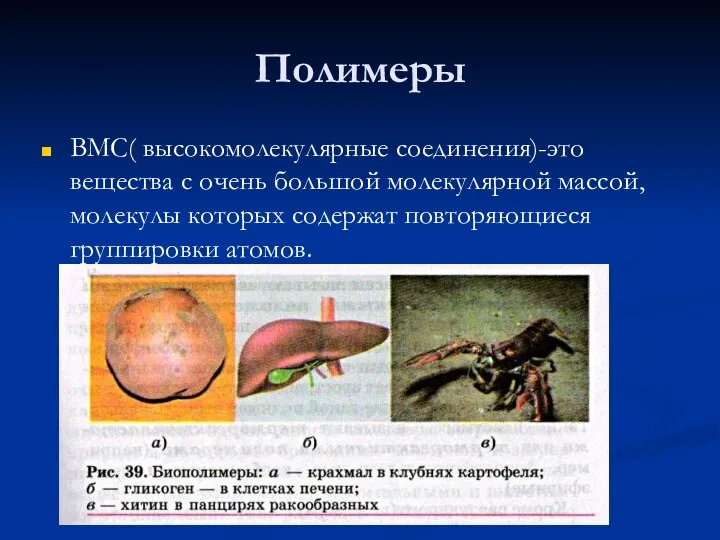 Полимеры
Полимеры Вода как растворитель. Растворы. Растворимость. 8 класс
Вода как растворитель. Растворы. Растворимость. 8 класс Описание молекул
Описание молекул Презентация на тему Водородная связь (11 класс)
Презентация на тему Водородная связь (11 класс)  Презентация на тему Реакции соединения (8 класс)
Презентация на тему Реакции соединения (8 класс)  Коррозия металлов, сплавов
Коррозия металлов, сплавов Презентация на тему Химия в криминалистике
Презентация на тему Химия в криминалистике  Пидорасня
Пидорасня Презентация по Химии "Алмаз"
Презентация по Химии "Алмаз"  Металлы. Тестирование
Металлы. Тестирование Металлы и их соединения
Металлы и их соединения