Содержание
- 2. МЕХАНИЗМ ОБРАЗОВАНИЯ ИОННОЙ СВЯЗИ
- 3. КОВАЛЕНТНАЯ ХИМИЧЕСКАЯ СВЯЗЬ - это связь, возникающая между атомами за счет образования ОБЩИХ электронных пар.
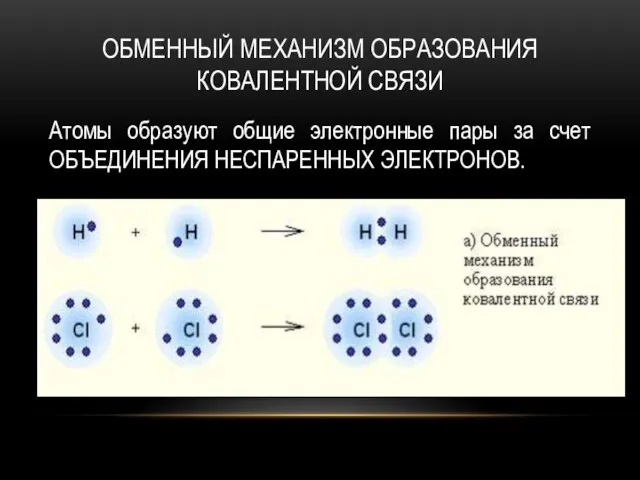
- 4. ОБМЕННЫЙ МЕХАНИЗМ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ Атомы образуют общие электронные пары за счет ОБЪЕДИНЕНИЯ НЕСПАРЕННЫХ ЭЛЕКТРОНОВ.
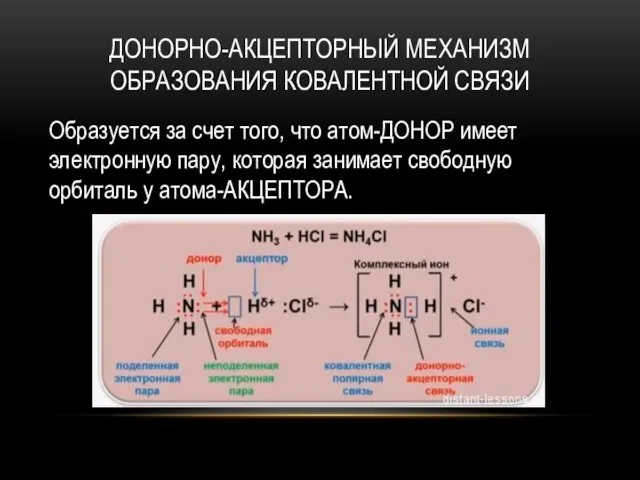
- 5. ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ Образуется за счет того, что атом-ДОНОР имеет электронную пару, которая занимает
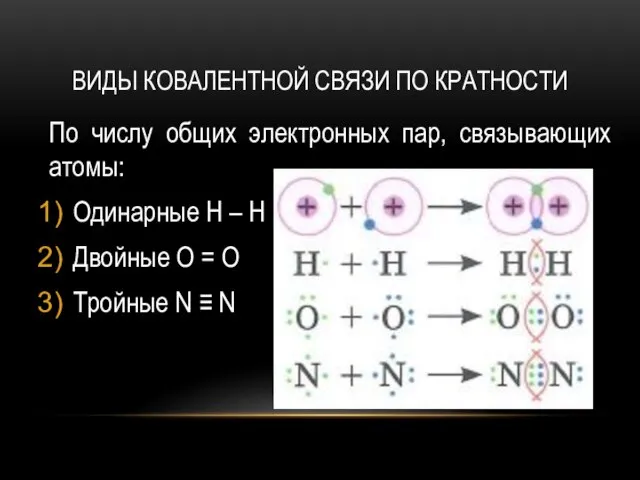
- 6. ВИДЫ КОВАЛЕНТНОЙ СВЯЗИ ПО КРАТНОСТИ По числу общих электронных пар, связывающих атомы: Одинарные H – H
- 7. ВИДЫ КОВАЛЕНТНОЙ СВЯЗИ ПО СТЕПЕНИ СМЕЩЕННОСТИ ОБЩИХ ЭЛЕКТРОННЫХ ПАР Неполярная Полярная Электроотрицательность – свойство атомов химического
- 8. НЕПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ Ковалентную химическую связь, образующуюся между атомами с одинаковой электроотрицательностью, называют неполярной.
- 9. ПОЛЯРНАЯ КОВАЛЕНТНАЯ СВЯЗЬ Ковалентную химическую связь, образующуюся между атомами с разной электроотрицательностью, называют полярной.
- 10. ПОЛЯРНОСТЬ МОЛЕКУЛЫ Полярность молекулы зависит от: полярности связей; геометрии молекулы.
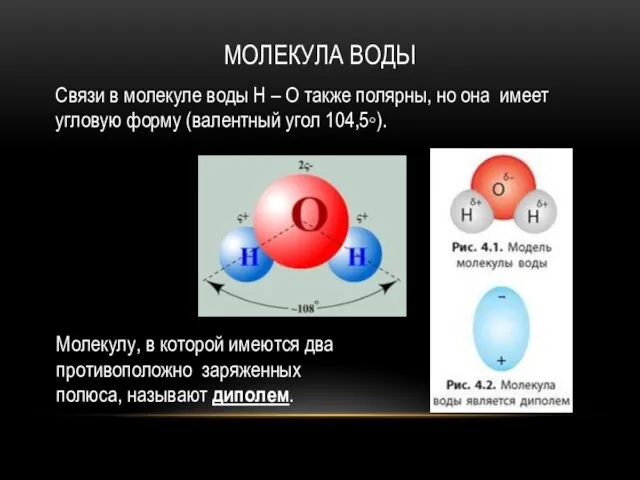
- 11. МОЛЕКУЛА ВОДЫ Связи в молекуле воды H – O также полярны, но она имеет угловую форму
- 12. ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК Для веществ с ковалентной связью характерны два типа кристаллических решеток: молекулярные атомные
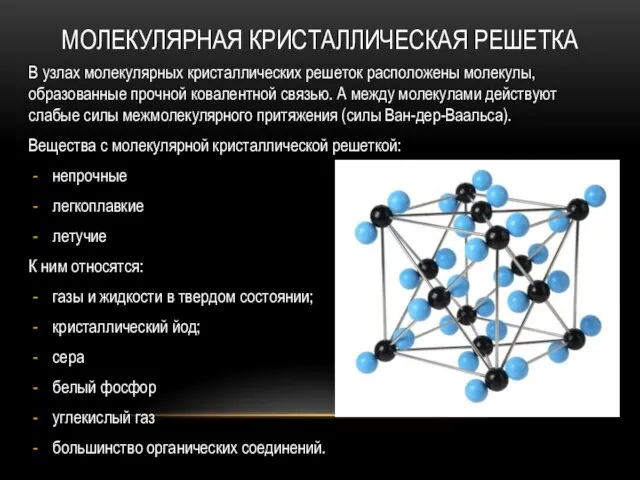
- 13. МОЛЕКУЛЯРНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА В узлах молекулярных кристаллических решеток расположены молекулы, образованные прочной ковалентной связью. А между
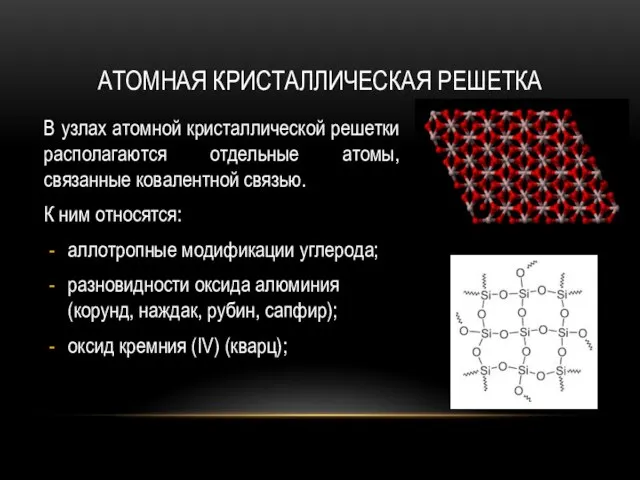
- 14. АТОМНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА В узлах атомной кристаллической решетки располагаются отдельные атомы, связанные ковалентной связью. К ним
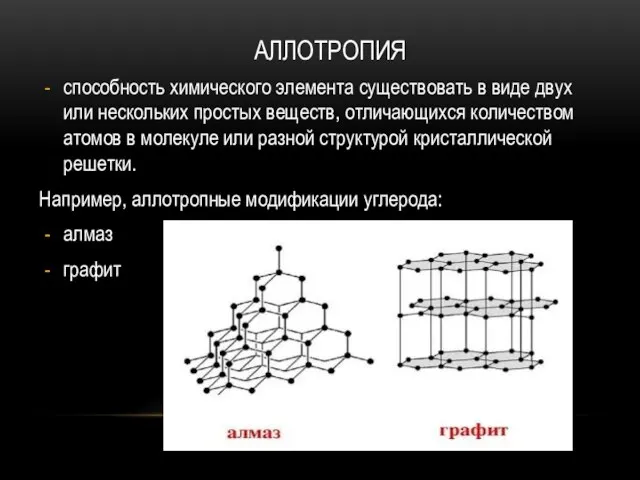
- 15. АЛЛОТРОПИЯ способность химического элемента существовать в виде двух или нескольких простых веществ, отличающихся количеством атомов в
- 16. ЗАДАНИЕ №1
- 17. ЗАДАНИЕ №2 ЗАДАНИЕ №3 Веществами с ковалентной полярной и ковалентной неполярной связью являются соответственно: 1) хлор
- 19. Скачать презентацию









 Алкины
Алкины Использование элементов модульной технологии на уроках химии
Использование элементов модульной технологии на уроках химии Алмаз, бриллиант
Алмаз, бриллиант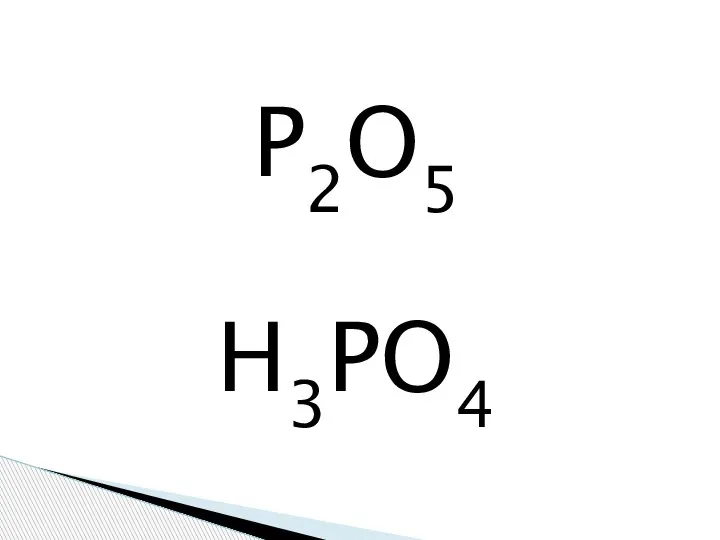 Фосфорная кислота
Фосфорная кислота Вычисление температур стеклования полимера при различных степенях отверждения смолы
Вычисление температур стеклования полимера при различных степенях отверждения смолы Презентация на тему Синтетические каучуки, строение, свойства, применение
Презентация на тему Синтетические каучуки, строение, свойства, применение  Концентрированная серная кислота
Концентрированная серная кислота Синтетические моющие средства (СМС). Наша стирка по-байкальски
Синтетические моющие средства (СМС). Наша стирка по-байкальски Нуклеиновые кислоты
Нуклеиновые кислоты Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Искусственные полимеры
Искусственные полимеры Соли. Состав солей
Соли. Состав солей Кристаллическое состояние полимеров
Кристаллическое состояние полимеров Презентация на тему Синтетические моющие средства
Презентация на тему Синтетические моющие средства  Ковалентная неполярная связь
Ковалентная неполярная связь Химическая связь и строение вещества
Химическая связь и строение вещества Презентация на тему Гормоны
Презентация на тему Гормоны  Структура периодической таблицы
Структура периодической таблицы Презентация на тему Растворение. Растворы (8 класс)
Презентация на тему Растворение. Растворы (8 класс)  Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов
Моноенаминирование 4-пиронов и 4-метилен-4н-пиранов Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Презентация на тему Основные законы науки химии
Презентация на тему Основные законы науки химии  Викторина Важнейшие классы веществ. Химические реакции. 8 класс
Викторина Важнейшие классы веществ. Химические реакции. 8 класс Химия и краски
Химия и краски Выращивание кристаллов соли (домашний эксперимент)
Выращивание кристаллов соли (домашний эксперимент) Презентация на тему Всё о кремнии
Презентация на тему Всё о кремнии  Химическая картина мира
Химическая картина мира Интерактивная интеллектуальная игра юный химик
Интерактивная интеллектуальная игра юный химик