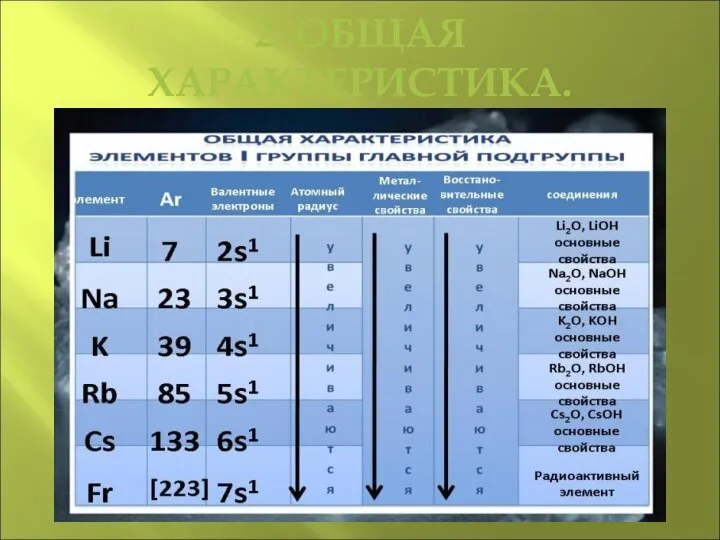
Слайд 21. ОПРЕДЕЛЕНИЕ.
Щелочные металлы – это металлы главной подгруппы I группы.К ним

относятся литий, натрий, калий, рубидий, цезий, франций. Они встречаются в природе в форме соединений, содержащих однозарядные катионы. Многие минералы содержат в своём составе щелочные металлы. Например, ортоклаз, или полевой шпат, состоит из алюмюсиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16].
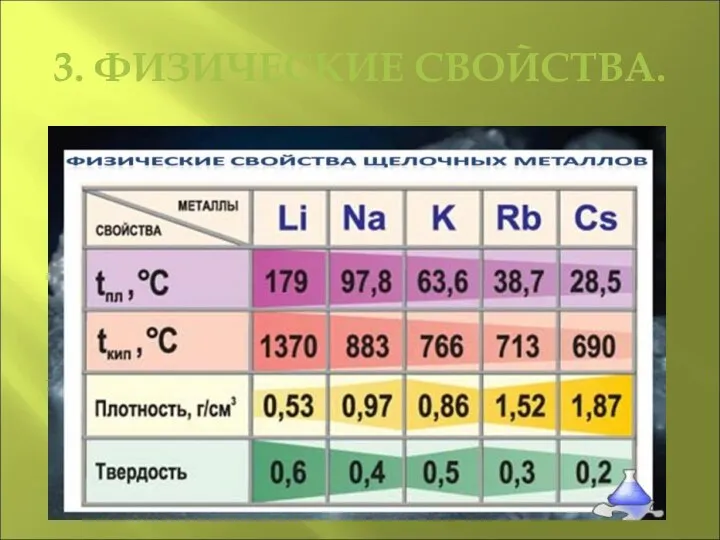
Слайд 64. ХИМИЧЕСКИЕ СВОЙСТВА.
Из-за высокой химической активности щелочных металлов по отношению к

воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
Слайд 7а) Ваимодействие с водой.
Взаимодействие с водой. Важное свойство щелочных металлов —

их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
Слайд 8б) Взаимодействие с кислородом.
Взаимодействие с кислородом. Продукты горения щелочных металлов

на воздухе имеют разный состав в зависимости от активности металла.
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
Слайд 9Формула
кислородного
соединения
Li2O Белый
Na2O Белый
K2O Желтоватый
Rb2O Жёлтый
Cs2O

Оранжевый
Na2O2 Светло-жёлтый
KO2 Оранжевый
RbO2 Тёмно-коричневый
CsO2 Жёлтый
Цвет
Слайд 10в) Получение оксидов.
Для получения оксидов натрия и калия нагревают смеси гидроксида,

пероксида или надпероксида с избытком металла в отсутствие кислорода:
Слайд 11г) Взаимодействие с другими веществами.
Щелочные металлы реагируют со многими неметаллами.

При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов:
Слайд 12 Щелочные металлы растворяются в жидком аммиаке и его производных — аминах

и амидах:
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:
Слайд 13
Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми

кислотами (с образованием солей):
Слайд 145. Получение щелочных металлов.
1. Для получения щелочных металлов используют в основном

электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
Слайд 15ИНТЕРЕСНЫЕ ФАКТЫ.
ДЛЯ ЧЕГО НУЖЕН ЦИАНИСТЫЙ КАЛИЙ? Для извлечения золота и серебра

из руд. Для гальванического золочения и серебрения неблагородных металлов. Для получения многих органических веществ. Для азотирования стали - это придаёт её поверхности большую прочность.
К сожалению, это очень нужное вещество чрезвычайно ядовито. А выглядит KCN вполне безобидно: мелкие кристаллы белого цвета с коричневатыми или серым оттенком.
Слайд 16Цезий и давление
Все щелочные металлы сильно изменяются под действием высокого

давления. Но именно цезий реагирует на него наиболее своеобразно и резко. При давлении в 100 тыс. атм. его объем уменьшается почти втрое – сильнее, чем у других щелочных металлов. Кроме того, именно в условиях высокого давления были обнаружены две новые модификации элементарного цезия. Электрическое сопротивление всех щелочных металлов с ростом давления увеличивается; у цезия это свойство выражено особенно сильно.













 Аллотропия. Аллотропные формы серы
Аллотропия. Аллотропные формы серы Презентация на тему Углекислый газ CO2
Презентация на тему Углекислый газ CO2  11 типы связей
11 типы связей Физико-химия полимеров
Физико-химия полимеров Свойства ртути
Свойства ртути Тема урока: «Свойства тканей из химических волокон»
Тема урока: «Свойства тканей из химических волокон» Периодическая система химических элементов Д.И. Меделеева
Периодическая система химических элементов Д.И. Меделеева Неметаллы. 8 класс
Неметаллы. 8 класс Металлы (Ме)
Металлы (Ме) Stereoselective total syntheses of guanacastepenes N and O
Stereoselective total syntheses of guanacastepenes N and O Способы очистки питьевой воды
Способы очистки питьевой воды Биогаз. Технология производства
Биогаз. Технология производства Электролитическая диссоциация
Электролитическая диссоциация Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Ионная химическая связь
Ионная химическая связь Презентация на тему Строение атома и атомного ядра
Презентация на тему Строение атома и атомного ядра  Химия. 8 класс
Химия. 8 класс Сколько нужно чистого белка
Сколько нужно чистого белка Характеристика 1-й аналитической группы анионов
Характеристика 1-й аналитической группы анионов Решение задач по схемам
Решение задач по схемам Мыло. Интересно об известном
Мыло. Интересно об известном Гидролиз солей. Лекция №18
Гидролиз солей. Лекция №18 Биосинтез фенольных соединений в растениях
Биосинтез фенольных соединений в растениях Растворение
Растворение Основы кристаллографии
Основы кристаллографии Алкадиены. Закрепление пройденного материала
Алкадиены. Закрепление пройденного материала Внеклассное мероприятие по химии Первоначальные химические понятия
Внеклассное мероприятие по химии Первоначальные химические понятия Химический элемент. Изотопы. Ионы
Химический элемент. Изотопы. Ионы