Содержание
- 2. План урока. Закон сохранения массы и энергии. Тепловой эффект химической реакции. Экзотермические и эндотермические реакции. Термохимия.
- 3. Почему протекают химические реакции Закон сохранения массы и энергии. Масса веществ, вступающих в реакцию равна массе
- 4. Закон сохранения массы и энергии Взаимосвязь массы и энергии выражается уравнением Эйнштейна: E = mc2 где
- 5. Тепловые эффекты химических реакций нужны для многих технических расчетов. Представьте себя на минуту конструктором мощной ракеты,
- 6. Тепловые эффекты химических реакций. Химическая реакция заключается в разрыве одних и образовании других связей, поэтому она
- 7. Классификация реакций
- 8. Реакции, протекающие с выделением теплоты, проявляют положительный тепловой эффект (Q>0, DH С(тв) + 2 H2(г) =
- 9. Тепловой эффект химической реакции Количество теплоты, которое выделяется или поглощается в результате реакций между определенными количествами
- 11. Раздел химии, занимающийся изучением превращения энергии в химических реакциях, называется ТЕРМОХИМИЕЙ. Существует два важнейших закона термохимии.
- 12. закон Лавуазье–Лапласа Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком.
- 13. Второй закон термохимии был сформулирован в 1840 г российским академиком Г. И. Гессом: Тепловой эффект реакции
- 14. Сульфат натрия Na2SO4 можно получить двумя путями из едкого натра NaOH. Первый путь (одностадийный): 2 NaOH
- 15. Ученый, чьим именем назван основной закон термохимии, несколько лет работал врачом в Иркутске; по учебнику, написанному
- 17. Энтальпия это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании. Величина, характеризующая
- 18. Энтальпия и тепловой эффект противоположны по знаку При экзотермических реакциях, когда тепло выделяется, Δ Н отрицательно.
- 19. Как вычислить тепловой эффект реакции Тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции
- 20. энтропия Функция характеризующая степень беспорядка ΔS Чем больше частиц в системе, тем больше в системе беспорядка
- 21. Выводы Всякая химическая реакция характеризуется двумя энергетическими характеристиками: энтальпией (ΔH) и энтропией (ΔS). Для самопроизвольных реакций
- 22. Задача 5 При соединении 18 г алюминия с кислородом выделяется 547 кДж теплоты. Составьте термохимическое уравнение
- 24. Скачать презентацию





















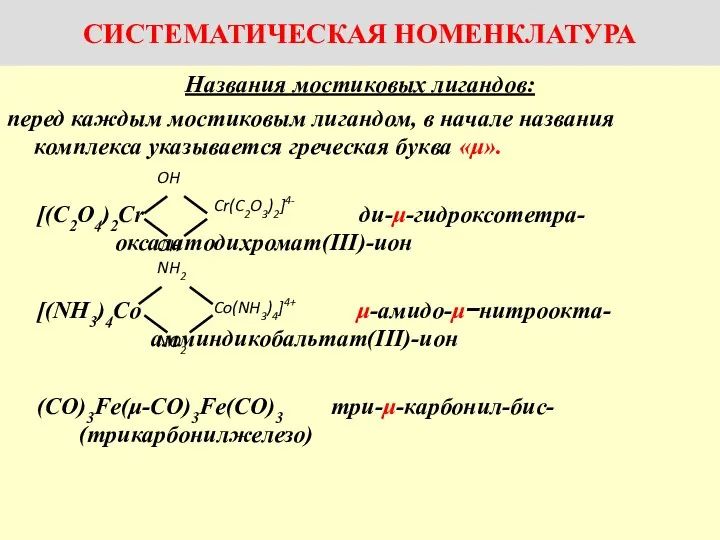 Названия комплексов с мостиковыми лигандами
Названия комплексов с мостиковыми лигандами Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов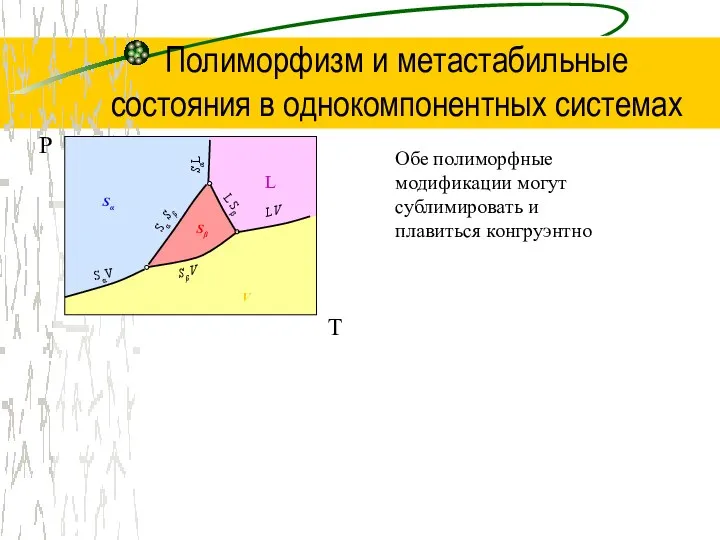 Полиморфизм и метастабильные состояния в однокомпонентных системах
Полиморфизм и метастабильные состояния в однокомпонентных системах Презентация на тему Викторина "Узнай химический элемент"
Презентация на тему Викторина "Узнай химический элемент"  Галогены
Галогены Углеводы, 2 часть. Лекция 15
Углеводы, 2 часть. Лекция 15 Азот. Нахождение в природе
Азот. Нахождение в природе Классификация веществ. Кислоты. Основания. Соли
Классификация веществ. Кислоты. Основания. Соли Алканы. Строение
Алканы. Строение Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай
Исследование снега на общую химическую токсичность методом биотестирования Автор: Милюта Юлия, Тюменская область, Тюменский рай Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Химия природная и синтетическая: за и против
Химия природная и синтетическая: за и против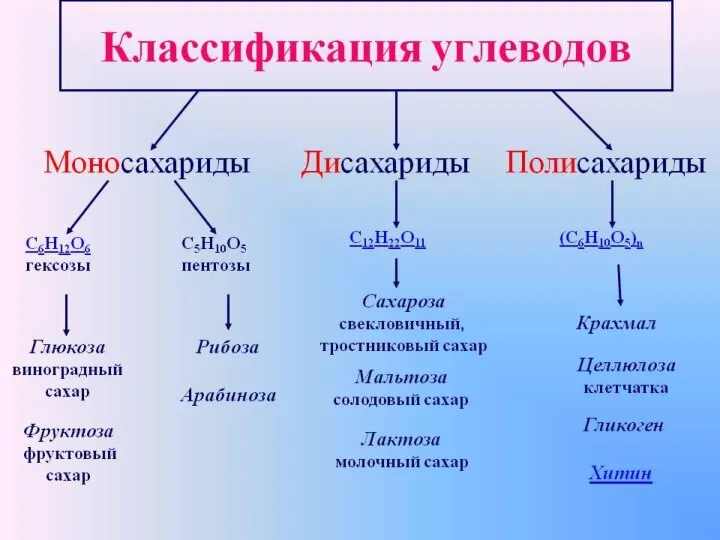 Классификация углеродов
Классификация углеродов Курсовой синтез ацетоуксусного эфира
Курсовой синтез ацетоуксусного эфира Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Характеристика химического элемента по его положению в ПСХЭ Д.И.Менделева
Характеристика химического элемента по его положению в ПСХЭ Д.И.Менделева Круговорот азота в природе
Круговорот азота в природе Арены. Бензол
Арены. Бензол Положение металлов в Периодической системе химических элементов Д.И.Менделеева
Положение металлов в Периодической системе химических элементов Д.И.Менделеева Стереоизомерия
Стереоизомерия Презентация на тему Аминокислоты. История их открытия
Презентация на тему Аминокислоты. История их открытия  Применение серы, хлора, углерода
Применение серы, хлора, углерода Фосфорні добрива. Технології збагачення фосфоровмісної сировини
Фосфорні добрива. Технології збагачення фосфоровмісної сировини Геометрия молекул
Геометрия молекул Синтез поликонденсационных полимеров
Синтез поликонденсационных полимеров Строение атома
Строение атома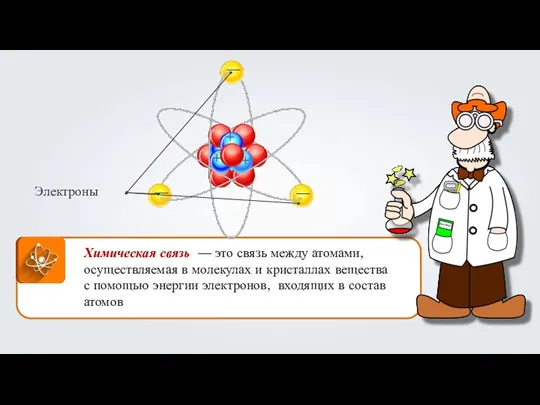 Ковалентная неполярная химическая связь
Ковалентная неполярная химическая связь Пищевые кислоты
Пищевые кислоты