Содержание
- 2. Существует физическая величина, прямо пропорциональная числу частиц, составляющих данное вещество и входящих во взятую порцию этого
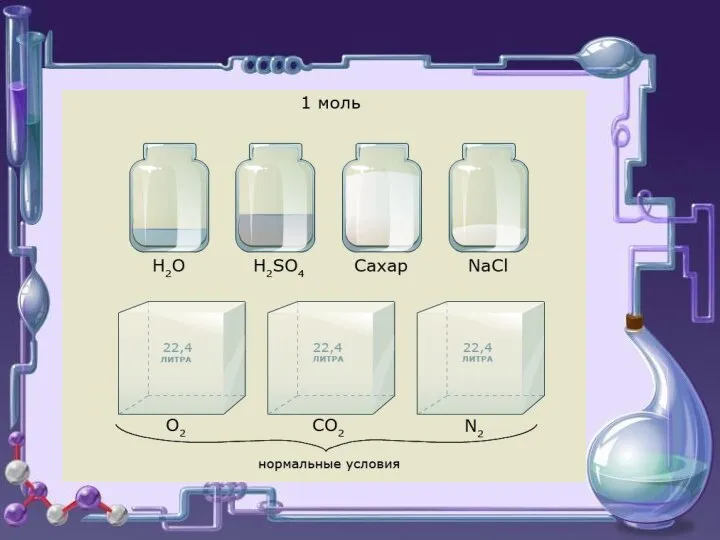
- 3. Количество вещества — физическая величина, — физическая величина, характеризующая количество однотипных структурных единиц, которые содержатся в
- 4. Молярная масса -это масса одного моля вещества. М=[г/моль] ( молярная масса численно равна молекулярной массе) ,
- 5. о Закон объемных отношений Измеряя объемы, и объемы газов, в результате реакции Ж.Л. Гей-Люссак открыл закон
- 6. Например
- 7. Закон объёмных отношений позволил итальянскому учёному А. Авогадро предположить, что молекулы простых газов состоят из двух
- 8. о о А. Авогадро 1811 Итальянский ученый Амадео Авогадро сформулировал закон (для газов) : в равных
- 9. Следствия (для газов) Отношение массы определённого объёма одного газа к массе такого же объёма другого газа,
- 11. Уравнение связи Где n- количество вещества (моль)
- 13. Скачать презентацию


![Молярная масса -это масса одного моля вещества. М=[г/моль] ( молярная масса численно](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1025476/slide-3.jpg)






 Алкадиены: кумулированные, сопряженные, изолированные
Алкадиены: кумулированные, сопряженные, изолированные Комплексные соединения
Комплексные соединения Степень окисления (СО) – § 18
Степень окисления (СО) – § 18 8-9-10 химические формулы
8-9-10 химические формулы 175 – летию со дня рождения Дмитрия Ивановича Менделеева посвящается… АВТОР ПРЕЗЕНТАЦИИ: учитель химии МОУ СОШ №2 города Ртищево Саратовской области ПОПКОВА Е.Г.
175 – летию со дня рождения Дмитрия Ивановича Менделеева посвящается… АВТОР ПРЕЗЕНТАЦИИ: учитель химии МОУ СОШ №2 города Ртищево Саратовской области ПОПКОВА Е.Г. Термодинамика. Лекция №2
Термодинамика. Лекция №2 Презентация на тему "Водород"
Презентация на тему "Водород" Неметаллы в ПСХЭ
Неметаллы в ПСХЭ Презентация на тему Водород (9 класс)
Презентация на тему Водород (9 класс)  Эмульсия. Основные типы эмульсий
Эмульсия. Основные типы эмульсий Химический анализ
Химический анализ Биохимия, как наука
Биохимия, как наука Спирты, карбоновые кислоты
Спирты, карбоновые кислоты Осторожно, химия
Осторожно, химия Вуглеводні. Метан як представник насичених вуглеводнів
Вуглеводні. Метан як представник насичених вуглеводнів Оксиды и их свойства
Оксиды и их свойства Альдегиды. Кетоны
Альдегиды. Кетоны Минералы
Минералы Железо Fe
Железо Fe Способы получения металлов
Способы получения металлов Увлекательный мир химии
Увлекательный мир химии Оловянная чума
Оловянная чума Индолы. Cтроение индола
Индолы. Cтроение индола Патриотическое воспитание школьников на уроках
Патриотическое воспитание школьников на уроках AMFOTERNOST__1
AMFOTERNOST__1 Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас
Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас 5кл 20.10практична робота
5кл 20.10практична робота Презентация на тему Оксиды
Презентация на тему Оксиды