Содержание
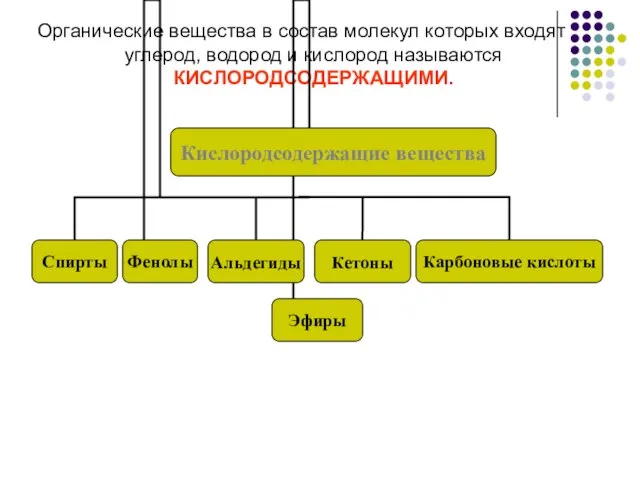
- 2. Органические вещества в состав молекул которых входят углерод, водород и кислород называются КИСЛОРОДСОДЕРЖАЩИМИ.
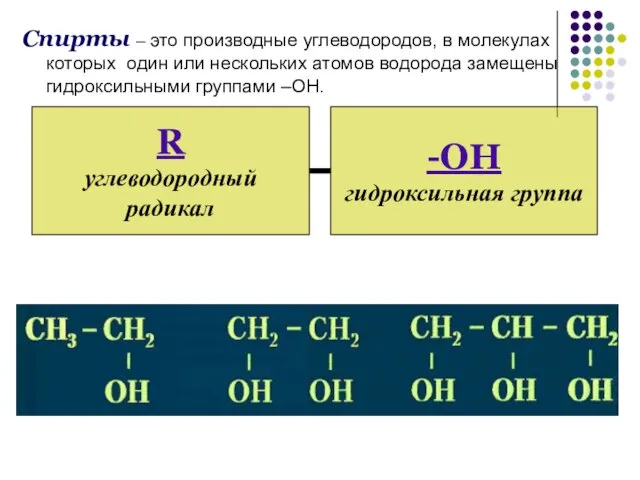
- 3. Спирты – это производные углеводородов, в молекулах которых один или нескольких атомов водорода замещены гидроксильными группами
- 4. Номенклатура спиртов выбираем наиболее длинную углеродную цепь, содержащую гидроксильные группы. нумеруем атомы углерода, так чтобы сумма
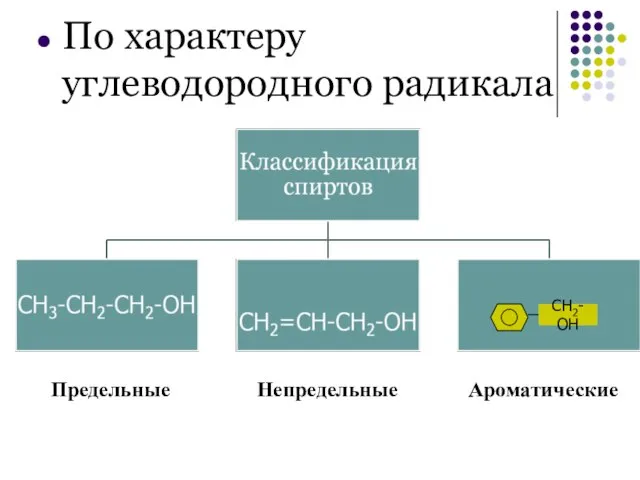
- 5. По характеру углеводородного радикала Предельные Непредельные Ароматические
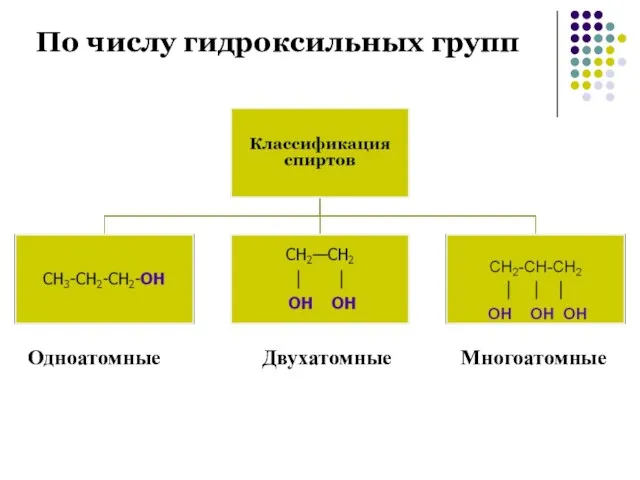
- 6. По числу гидроксильных групп Одноатомные Двухатомные Многоатомные
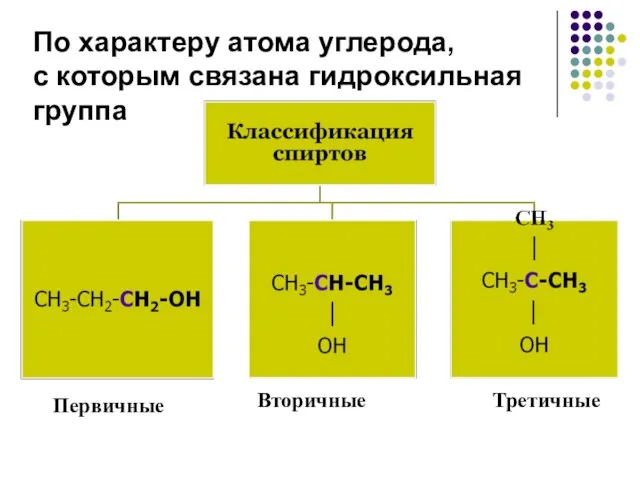
- 7. По характеру атома углерода, с которым связана гидроксильная группа Первичные Вторичные Третичные
- 8. Дайте название веществам 1. СН3-СН2-СН2-СН2-ОН 2. СН3-СН-СН2-ОН │ СН3 3. СН3-СН-СН2-СН3 │ ОН СН3 │ 4.
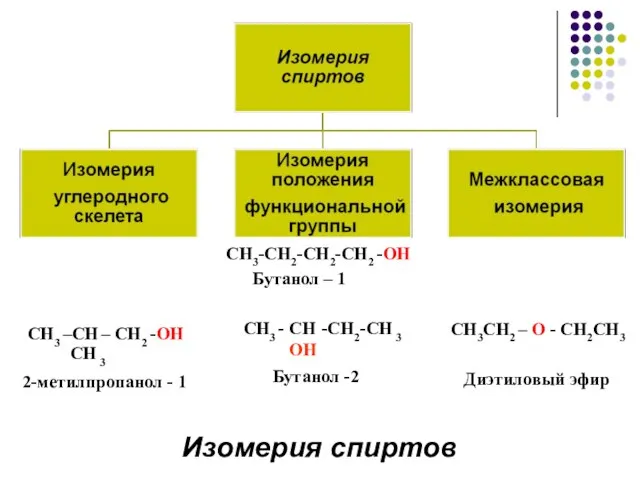
- 9. СН3-СН2-СН2-СН2 -ОН Бутанол – 1 СН3 - СН -СН2-СН 3 OH Бутанол -2 СН3 –СН –
- 10. Строение спиртов Связи О–Н и С–О - полярные ковалентные. Это следует из различий в электроотрицательности кислорода,
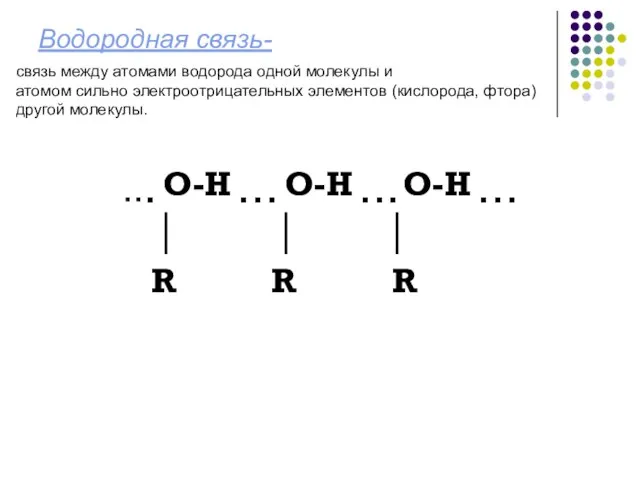
- 11. Водородная связь- ▪ ▪ ▪ О-Н ▪ ▪ ▪ О-Н ▪ ▪ ▪ О-Н ▪ ▪
- 12. Физические свойства Агрегатное состояние: С1-С11- жидкости С12 –С…- твердые вещества Запах С1-С3- «спиртовой» запах С4-С6- «сивушный»
- 13. Домашнее задание Параграф 15, записи в тетради, В.1 + изомеры
- 14. Ответьте на вопросы 1. Чем объясняется разница в растворимости этанола и пропанола в воде? 2.Известно, что
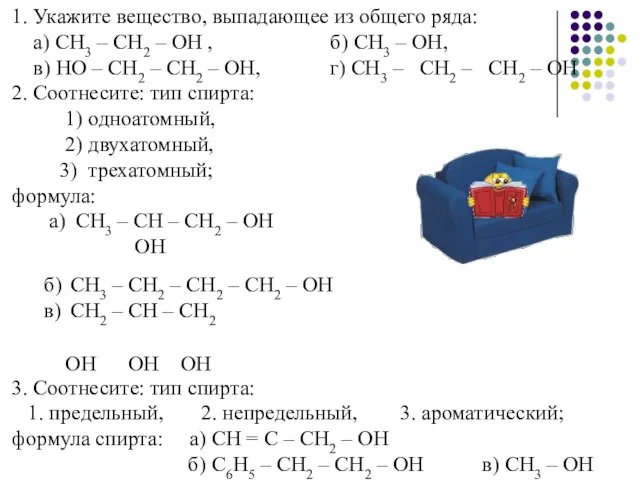
- 15. 1. Укажите вещество, выпадающее из общего ряда: а) СН3 – СН2 – ОН , б) СН3
- 16. 4. Общая формула гомологического ряда предельных одноатомных спиртов: а) СnН2n -1ОН, б) СnН2 n +1ОН, в)
- 17. СН3 8. Название вещества с формулой СН3– СН – С (СН3)2– СН3 ОН а) 3,3-диметилбутанол-2, б)
- 18. Домашнее задание: § 11, вопросы № 1 – 8 (устно); 9,10 (письменно).
- 19. Получение спиртов. 1.Гидратацией алкенов. СН2=СН2+ Н2О →СН3-СН2-ОН 2. Специфические а)Метанола – из синтез – газа СО+2Н2→СН3ОН
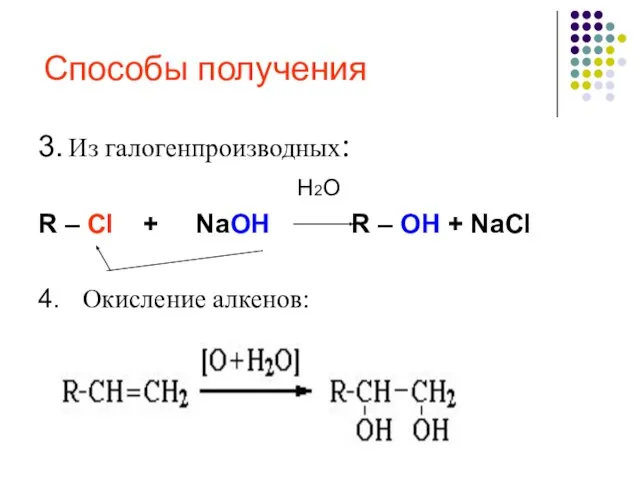
- 20. Способы получения 3. Из галогенпроизводных: H2O R – Cl + NaOH R – OH + NaCl
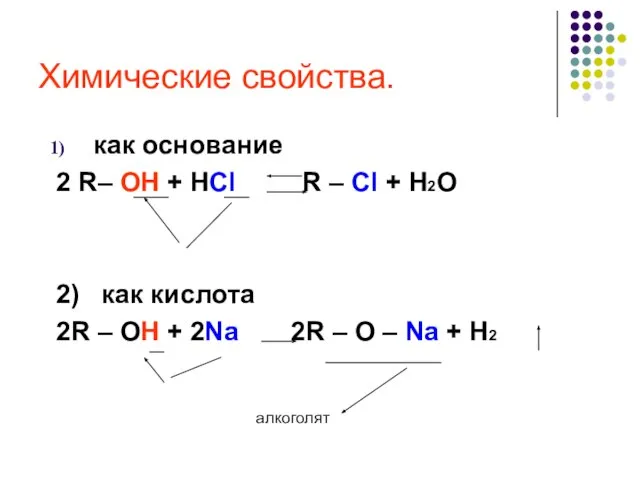
- 21. Химические свойства спиртов В химических реакциях гидроксисоединений возможно разрушение одной из двух связей: С–ОН с отщеплением
- 22. Химические свойства. как основание 2 R– OH + HCl R – Cl + H2O 2) как
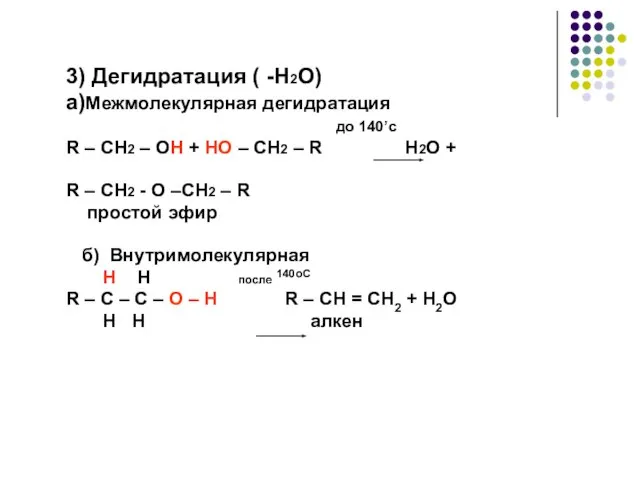
- 23. 3) Дегидратация ( -H2O) a)Межмолекулярная дегидратация до 140’с R – CH2 – OH + HO –
- 24. Реакция этерификации Спирты вступают в реакции с минеральными и органическими кислотами, образуя сложные эфиры. Реакция обратима
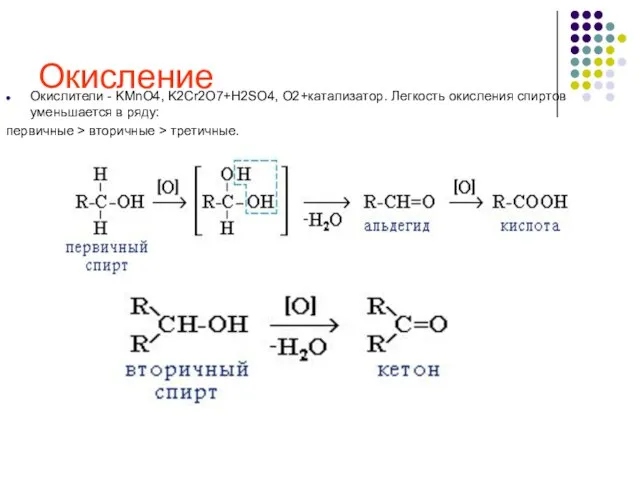
- 25. Окисление Окислители - KMnO4, K2Cr2O7+H2SO4, O2+катализатор. Легкость окисления спиртов уменьшается в ряду: первичные > вторичные >
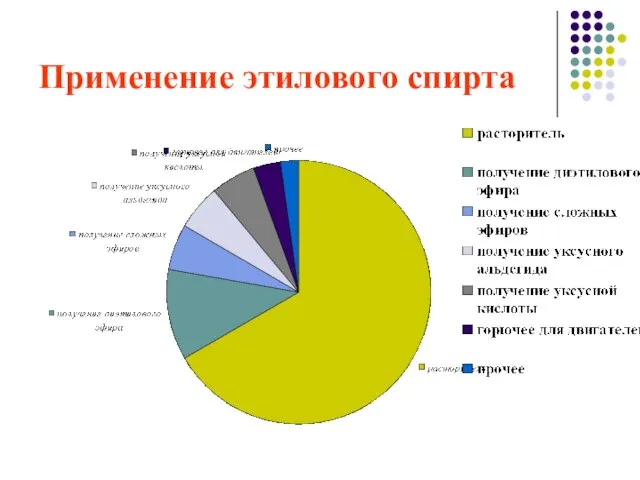
- 26. Применение этилового спирта
- 27. Спирт - ксенобиотик Ксенобиотики – это вещества, которые не содержатся в человеческом организме, но влияют на
- 28. Тестирование http://www.chemistry.ssu.samara.ru/test/ROH.htm
- 30. Скачать презентацию













 Классификация и номенклатура ОС
Классификация и номенклатура ОС Контрольная работа №1
Контрольная работа №1 Переработка нефти. 10 класс
Переработка нефти. 10 класс Золото
Золото Презентация на тему Предельные углеводороды
Презентация на тему Предельные углеводороды  Водневий та металічний звязок
Водневий та металічний звязок Межкристаллитная коррозия МКК
Межкристаллитная коррозия МКК Эквивалент. Закон эквивалентов
Эквивалент. Закон эквивалентов Химическая замена
Химическая замена DOC-20221011-WA0003
DOC-20221011-WA0003 20140111_mineraly
20140111_mineraly Методы выделения и разделения радионуклидов
Методы выделения и разделения радионуклидов Графит. Химические свойства
Графит. Химические свойства Занимательная химия Программу составил
Занимательная химия Программу составил  Основы аналитической химии
Основы аналитической химии Презентация на тему Общая характеристика подгруппы углерода
Презентация на тему Общая характеристика подгруппы углерода  Номенклатура алканов разветвленного строения
Номенклатура алканов разветвленного строения Заманауи косметика биотехнологиясы
Заманауи косметика биотехнологиясы Спирты или алканолы
Спирты или алканолы Генетическая связь между неорганическими соединениями.
Генетическая связь между неорганическими соединениями. Диссоциация оснований, кислот, солей
Диссоциация оснований, кислот, солей Астат. Свойства астата
Астат. Свойства астата Ароматические углеводороды
Ароматические углеводороды Алкены. Физические и химические свойства
Алкены. Физические и химические свойства Презентация на тему Водородная связь (11 класс)
Презентация на тему Водородная связь (11 класс)  Несовершенства и дефекты кристаллической решетки полимеров
Несовершенства и дефекты кристаллической решетки полимеров Замедленное коксование гудрона
Замедленное коксование гудрона Исследовательская работа по химии на тему: Интегративные проблемные ситуации
Исследовательская работа по химии на тему: Интегративные проблемные ситуации