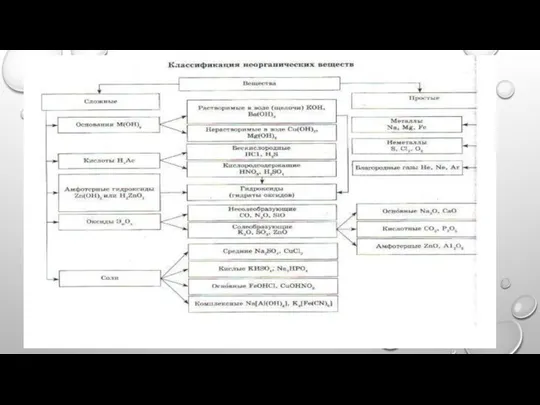
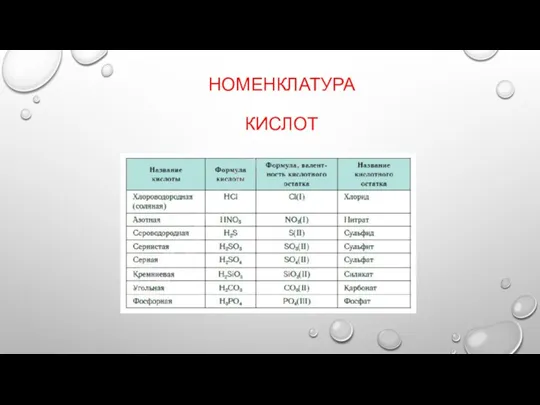
Слайд 12НОМЕНКЛАТУРА
1) В НАЗВАНИИ КОМПЛЕКСНОГО СОЕДИНЕНИЯ ПЕРВЫМ УКАЗЫВАЮТ ОТРИЦАТЕЛЬНО ЗАРЯЖЕННУЮ ЧАСТЬ —АНИОН, ЗАТЕМ ПОЛОЖИТЕЛЬНУЮ

ЧАСТЬ — КАТИОН.
2) НАЗВАНИЕ КОМПЛЕКСНОЙ ЧАСТИ НАЧИНАЮТ С УКАЗАНИЯ СОСТАВА ВНУТРЕННЕЙ СФЕРЫ. ВО ВНУТРЕННЕЙ СФЕРЕ ПРЕЖДЕ ВСЕГО НАЗЫВАЮТ ЛИГАНДЫ — АНИОНЫ, ПРИБАВЛЯЯ К ИХ ЛАТИНСКОМУ НАЗВАНИЮ ОКОНЧАНИЕ «О». НАПРИМЕР: CL− — ХЛОРО, CN− — ЦИАНО, SCN− — ТИОЦИАНАТО, NO3− — НИТРАТО, SO32− — СУЛЬФИТО, OH− — ГИДРОКСО И Т. Д. ПРИ ЭТОМ ПОЛЬЗУЮТСЯ ТЕРМИНАМИ: ДЛЯ КООРДИНИРОВАННОГО АММИАКА — АММИН, ДЛЯ ВОДЫ — АКВА, ДЛЯ ОКСИДА УГЛЕРОДА(II) — КАРБОНИЛ.
3) ЧИСЛО МОНОДЕНТАТНЫХ ЛИГАНДОВ УКАЗЫВАЮТ ГРЕЧЕСКИМИ ЧИСЛИТЕЛЬНЫМИ: 1 — МОНО (ЧАСТО НЕ ПРИВОДИТСЯ), 2 — ДИ, 3 — ТРИ, 4 — ТЕТРА, 5 — ПЕНТА, 6 — ГЕКСА. ДЛЯ ПОЛИДЕНТАТНЫХ ЛИГАНДОВ (НАПРИМЕР, ЭТИЛЕНДИАМИН, ОКСАЛАТ) ИСПОЛЬЗУЮТ БИС-, ТРИС-, ТЕТРАКИС- И Т. Д.
4) ЗАТЕМ НАЗЫВАЮТ КОМПЛЕКСООБРАЗОВАТЕЛЬ, ИСПОЛЬЗУЯ КОРЕНЬ ЕГО ЛАТИНСКОГО НАЗВАНИЯ И ОКОНЧАНИЕ -АТ, ПОСЛЕ ЧЕГО РИМСКИМИ ЦИФРАМИ УКАЗЫВАЮТ (В СКОБКАХ) СТЕПЕНЬ ОКИСЛЕНИЯ КОМПЛЕКСООБРАЗОВАТЕЛЯ.
5) ПОСЛЕ ОБОЗНАЧЕНИЯ СОСТАВА ВНУТРЕННЕЙ СФЕРЫ НАЗЫВАЮТ ВНЕШНЮЮ СФЕРУ.
6) В НАЗВАНИИ НЕЙТРАЛЬНЫХ КОМПЛЕКСНЫХ ЧАСТИЦ КОМПЛЕКСООБРАЗОВАТЕЛЬ УКАЗЫВАЕТСЯ В ИМЕНИТЕЛЬНОМ ПАДЕЖЕ, А СТЕПЕНЬ ЕГО НЕ УКАЗЫВАЕТСЯ, ТАК КАК ОНА ОДНОЗНАЧНО ОПРЕДЕЛЯЕТСЯ, ИСХОДЯ ИЗ ЭЛЕКТРОНЕЙТРАЛЬНОСТИ КОМПЛЕКСА.









 Стекло. Лекция №22
Стекло. Лекция №22 Химическая связь и ее типы
Химическая связь и ее типы Лёгкие металлы
Лёгкие металлы (+)-Plumisclerin A. Плюмисклин А
(+)-Plumisclerin A. Плюмисклин А Основные сведения о металлах и сплавах и их свойства
Основные сведения о металлах и сплавах и их свойства Побочная подгруппа VIII группы
Побочная подгруппа VIII группы Приходченко ФЕР-2031
Приходченко ФЕР-2031 Методы получения нафтиридинов (всех изомеров)
Методы получения нафтиридинов (всех изомеров) Тема: «Первоначальные сведения о строении вещества»
Тема: «Первоначальные сведения о строении вещества» Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Химические свойства спиртов и фенола
Химические свойства спиртов и фенола Взаимное влияние атомов в молекулах
Взаимное влияние атомов в молекулах Основы химической термодинамики
Основы химической термодинамики Пименов_Химический состав
Пименов_Химический состав 28f89e0351fe4e509cc73515a12a26d5
28f89e0351fe4e509cc73515a12a26d5 lektsia_6 (1)
lektsia_6 (1) Экстракция
Экстракция Спирты
Спирты Строение атома. Экзаменационные вопросы
Строение атома. Экзаменационные вопросы Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота Лекция 3
Лекция 3 Тест по теме Альдегиды и кетоны
Тест по теме Альдегиды и кетоны Лекарственные средства – производные пиримидина
Лекарственные средства – производные пиримидина Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями)
Активизация познавательной деятельности на уроках химии при работе с МГП (малыми графическими пособиями) Мутагены окружающей среды
Мутагены окружающей среды Пептиды, белки. Лабораторное занятие
Пептиды, белки. Лабораторное занятие Демокрит его вклад в развитие взглядов на строение вещества
Демокрит его вклад в развитие взглядов на строение вещества Презентация на тему Дисперсные системы и растворы
Презентация на тему Дисперсные системы и растворы