Содержание
- 2. В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи:
- 3. Х И М И Ч Е С К А Я С В Я З Ь ЭНЕРГИЯ
- 4. Ионная химическая связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Такая
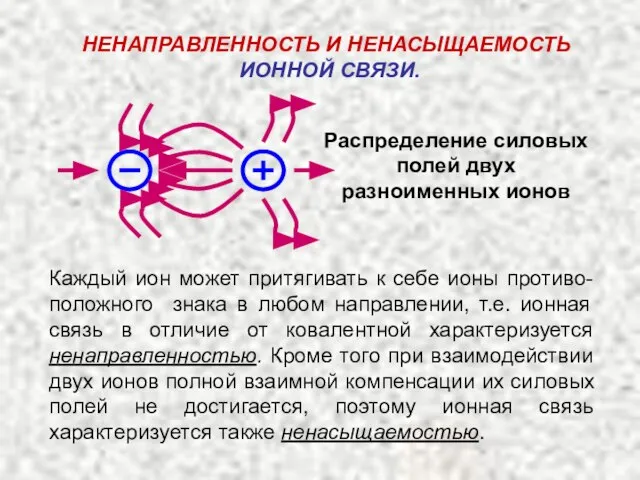
- 5. НEНАПРАВЛЕННОСТЬ И НЕНАСЫЩАЕМОСТЬ ИОННОЙ СВЯЗИ. Распределение силовых полей двух разноименных ионов Каждый ион может притягивать к
- 6. Чисто ионной связи не существует. Можно лишь говорить о степени (доле) ионности связи. Для оценки способности
- 7. ВЫВОД. Связи ионными на 100% практически не бывают. РАЗНОСТЬ ЭО АТОМОВ И СТЕПЕНЬ ИОННОСТИ СВЯЗИ Разность
- 8. Li 0,98 Na 0,93 К 0,91 Rb 0,89 Be 1,5 Mg 1,2 Ca 1,04 Sr 0,99
- 9. Химическая связь, образованная за счет обобществления пары электронов двумя атомами, называется ковалентной. ТЕОРИЯ КОВАЛЕНТНОЙ СВЯЗИ.
- 10. Особенностями ковалентной химической связи являются ее направленность и насыщаемость. Направленность ковалентной связи обуслов-ливается тем, что атомные
- 11. Из-за различия электроотрицательностей (ЭО) взаимодействующих атомов общая электронная пара почти всегда смещена в сторону атома с
- 12. примеры
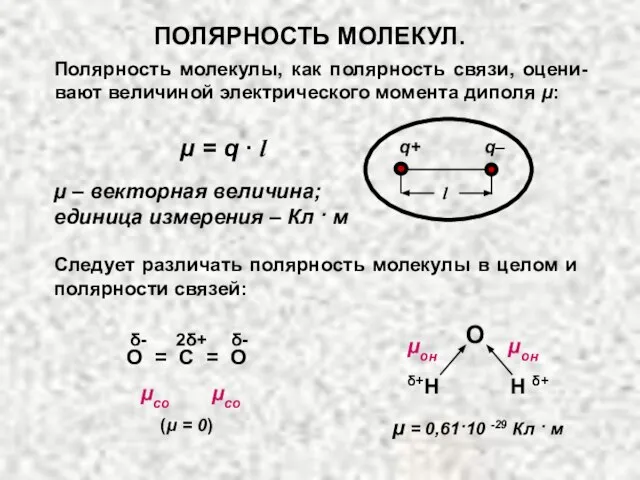
- 13. ПОЛЯРНОСТЬ МОЛЕКУЛ. Полярность молекул характеризуется значением электрического момента диполя μм, который равен векторной сумме электрических моментов
- 14. Полярность молекулы, как полярность связи, оцени-вают величиной электрического момента диполя μ: μ = q ∙ l
- 15. МЕТОДЫ ОПИСАНИЯ РАСПРЕДЕЛЕНИЯ ЭЛЕКТРОНОВ В МОЛЕКУЛАХ Для квантово-механического описания ковалентной связи и строения молекул используют два
- 16. В основе метода валентных связей (ВС) лежат следующие положения: а) химическая связь между двумя атомами возникает
- 17. в) Согласно методу ВС атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие
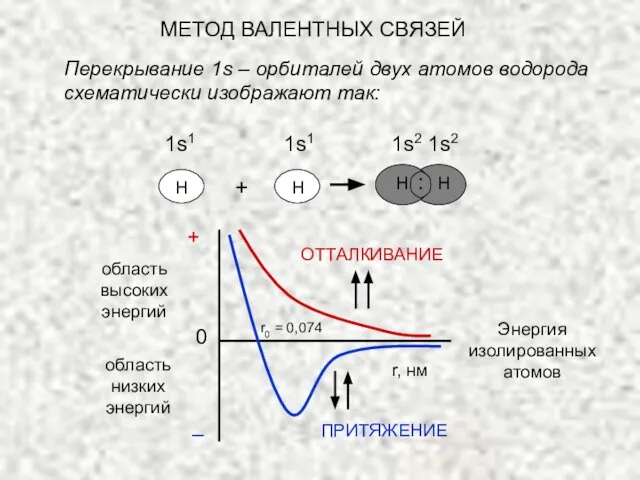
- 18. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ Перекрывание 1s – орбиталей двух атомов водорода схематически изображают так: Н Н Н
- 19. Способность атома присоединять или замещать определенное число других атомов с образованием химических связей называется валентностью. Количественной
- 20. Возбужденное состояние атома — это р а с с п а- р и в а н
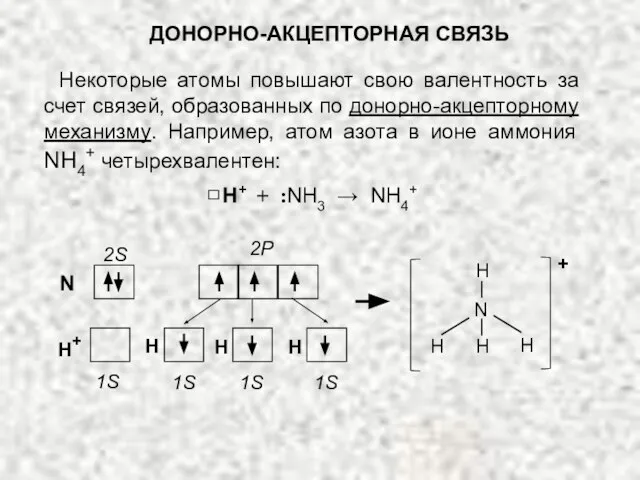
- 21. N 2S 2P H+ 1S 1S 1S 1S H H H Некоторые атомы повышают свою валентность
- 22. ВАЛЕНТНОСТЬ. Таким образом, суммарная валентность элемента равна числу неспаренных электронов (обменный механизм) плюс число связей, образованных
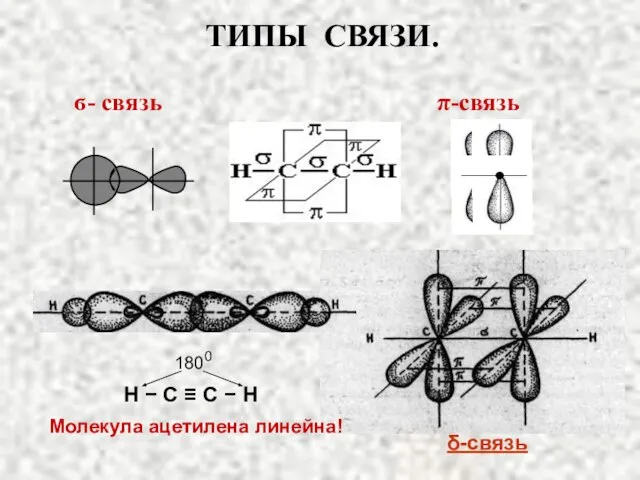
- 23. ТИПЫ СВЯЗИ. а) Связь, образованная перекрыванием АО по линии, соединяющей ядра взаимодействующих атомов, называется ϭ-связью (сигма-свяью)
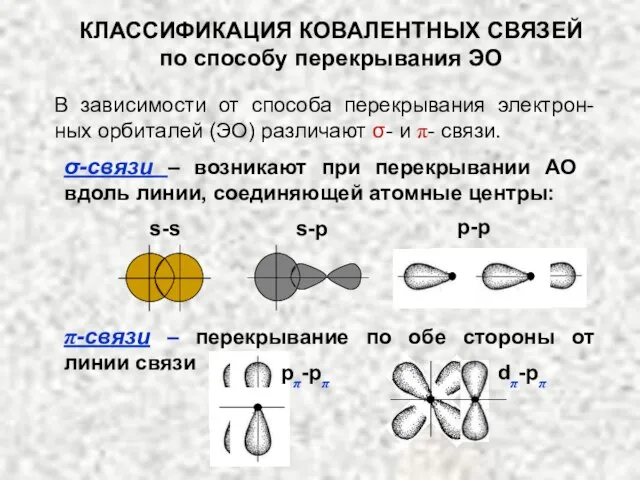
- 24. КЛАССИФИКАЦИЯ КОВАЛЕНТНЫХ СВЯЗЕЙ по способу перекрывания ЭО В зависимости от способа перекрывания электрон-ных орбиталей (ЭО) различают
- 25. ТИПЫ СВЯЗИ. π-Связи в молекулах или ионах, у которых возможно несколько способов локализации связей между атомами,
- 26. ϭ- связь π-связь Молекула ацетилена линейна! 1800 H − C ≡ C − H ТИПЫ СВЯЗИ.
- 27. ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ Гибридизация – смешение в процессе образования химической связи разных по форме и энергии
- 28. Благодаря гибридизации достигается бо′льшая прочность химических связей! Гибридная sр - орбиталь асимметрична и сильно вытянута, по
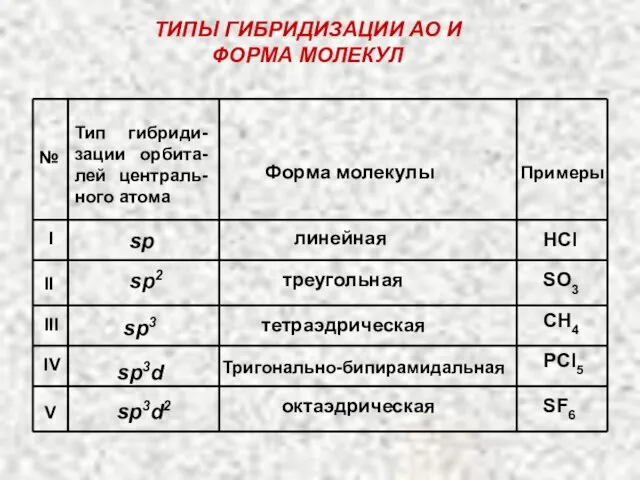
- 29. ПРОСТРАНСТВЕННАЯ КОНФИГУРАЦИЯ МОЛЕКУЛ. Гибридизация АО определяет пространственную конфигурацию молекул: 1) например, при sp-гибридизации образуются линейные молекулы;
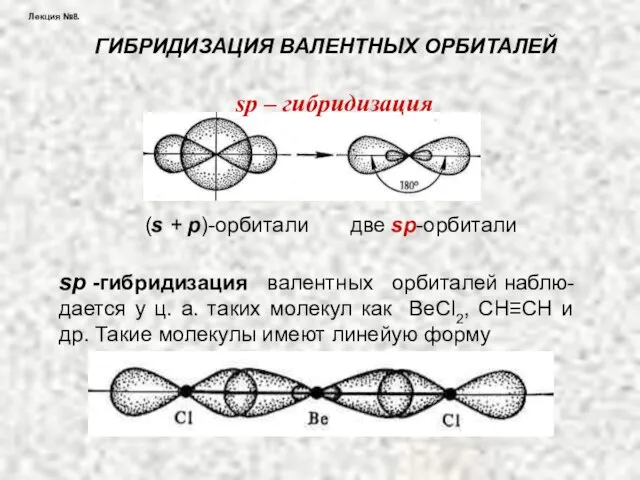
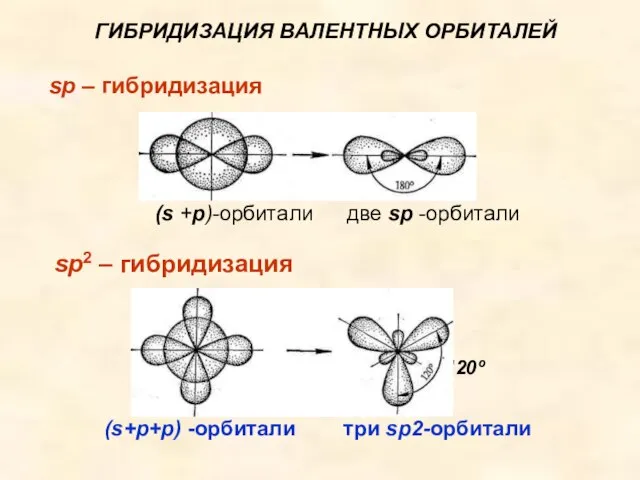
- 30. Лекция №8. ГИБРИДИЗАЦИЯ ВАЛЕНТНЫХ ОРБИТАЛЕЙ (s + р)-орбитали две sр-орбитали sp – гибридизация sр -гибридизация валентных
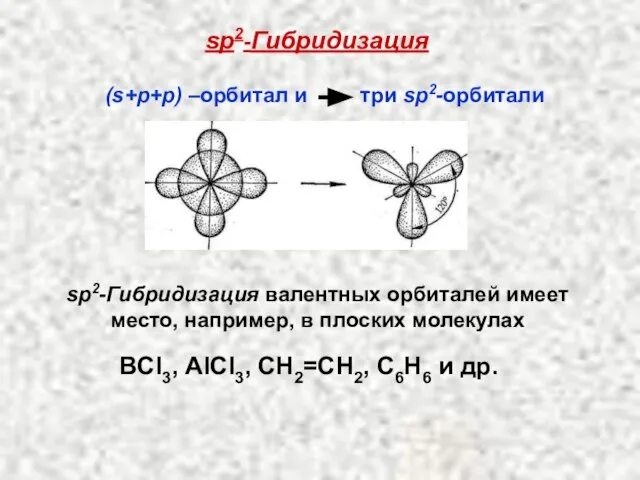
- 31. sp2-Гибридизация sр2-Гибридизация валентных орбиталей имеет место, например, в плоских молекулах (s+p+p) –орбитал и три sp2-орбитали ВCl3,
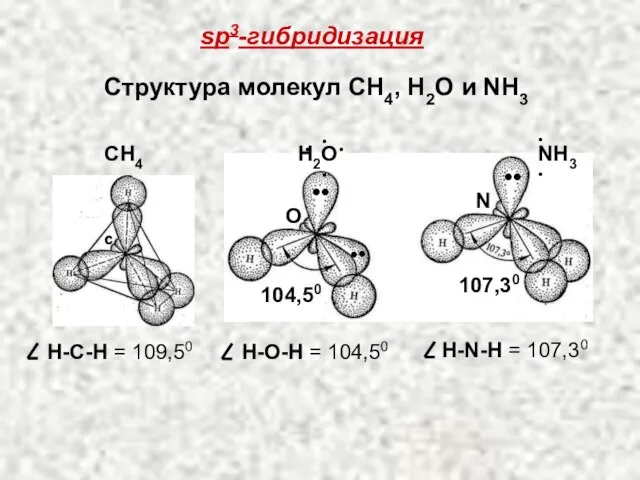
- 32. sp3-гибридизация Структура молекул СН4, Н2О и NН3 CН4 О N C 104,50 107,30 Н-C-Н = 109,50
- 33. ТИПЫ ГИБРИДИЗАЦИИ АО И ФОРМА МОЛЕКУЛ
- 34. sp2 – гибридизация ГИБРИДИЗАЦИЯ ВАЛЕНТНЫХ ОРБИТАЛЕЙ sp – гибридизация 120º (s +р)-орбитали две sр -орбитали (s+p+p)
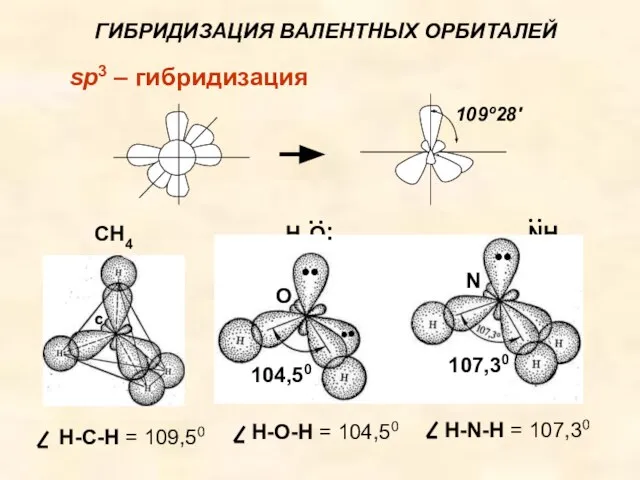
- 35. ГИБРИДИЗАЦИЯ ВАЛЕНТНЫХ ОРБИТАЛЕЙ sp3 – гибридизация CН4 Н2О NН3 О N C 104,50 107,30 Н-C-Н =
- 36. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ Обладает хорошей наглядностью: позволяет представить схему ковалентных связей в молекуле с помощью черточек.
- 37. ТЕОРИЯ МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ (ТМО) Основана на следующих представлениях: 1. Молекула, как атом, имеет «орбитальное» строение Обозначение:
- 38. 4. Молекулярные орбитали находят в результате линейной комбинации (сложения и вычитания) исходных атомных орбиталей (ЛКАО ММО):
- 39. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ. Основные положения метода МО: а) образование химических связей является результа-том перехода электронов с
- 40. г) распределение электронов по новым МО или энергетическим уровням производится в соответствии с принципом наименьшей энергии,
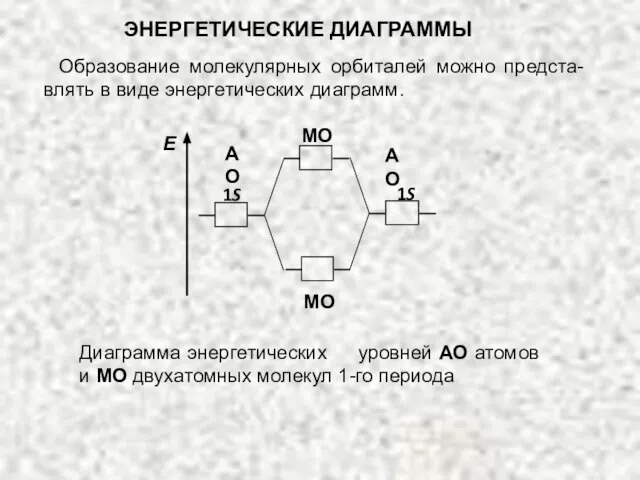
- 41. Диаграмма энергетических уровней АО атомов и МО двухатомных молекул 1-го периода Образование молекулярных орбиталей можно предста-влять
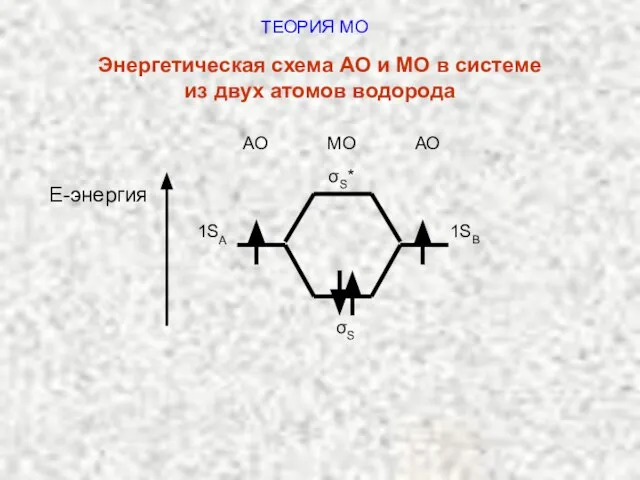
- 42. ТЕОРИЯ МО Энергетическая схема АО и МО в системе из двух атомов водорода АО МО АО
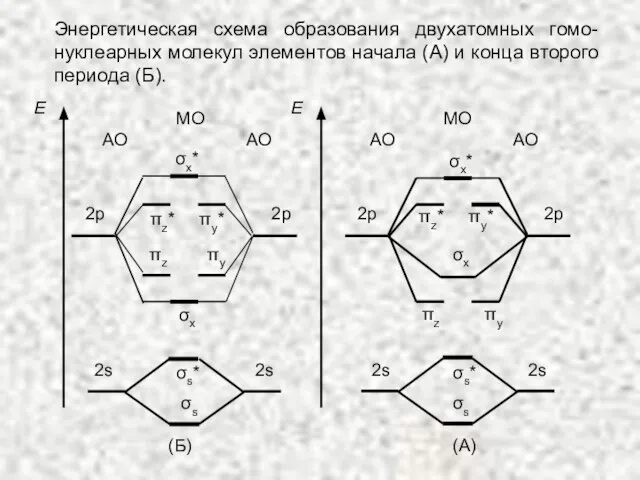
- 43. Энергетическая схема образования двухатомных гомо-нуклеарных молекул элементов начала (А) и конца второго периода (Б). МО АО
- 44. Взаимодействовать с образованием МО будут только те АО, которые удовлетворяют следующим требованиям: а) энергии комбинируемых АО
- 45. По возрастанию энергии МО орбитали двухатомных молекул первого периода и начала второго периода (до N2) можно
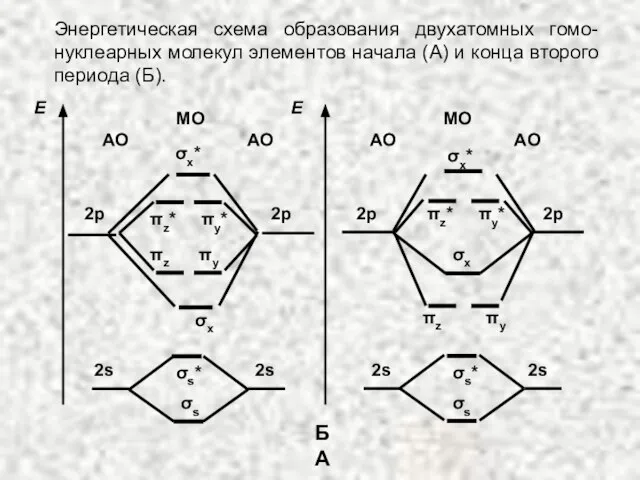
- 46. Энергетическая схема образования двухатомных гомо-нуклеарных молекул элементов начала (А) и конца второго периода (Б). МО АО
- 48. Скачать презентацию





























 Алканы 10-класс
Алканы 10-класс Периодическая система химических элементов. Периоды. Группы
Периодическая система химических элементов. Периоды. Группы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Подготовка к контрольной работе по теме «Изменения, происходящие с веществами
Подготовка к контрольной работе по теме «Изменения, происходящие с веществами Презентация на тему Теория строения органических соединений А. М. Бутлерова
Презентация на тему Теория строения органических соединений А. М. Бутлерова  Материаловедение и технология конструкционных материалов
Материаловедение и технология конструкционных материалов Основания. Классификация оснований
Основания. Классификация оснований Презентация на тему Научная химическая лаборатория Ломоносова
Презентация на тему Научная химическая лаборатория Ломоносова  Общие химические свойства металлов
Общие химические свойства металлов Udens ipasibas
Udens ipasibas кристал. решетки
кристал. решетки Вода – самое удивительное вещество на Земле
Вода – самое удивительное вещество на Земле Аминокислоты
Аминокислоты Изучение условий покрытий на основе Диатомита/ПАК и Каолина/ПАК
Изучение условий покрытий на основе Диатомита/ПАК и Каолина/ПАК Презентация на тему Роль химии в жизни человека
Презентация на тему Роль химии в жизни человека  Скорость протекания химических реакций
Скорость протекания химических реакций Пиримидин (шестичленный гетероцикл с двумя атомами азота)
Пиримидин (шестичленный гетероцикл с двумя атомами азота) Органические соединения в быту. Понятие о бытовых химикатах
Органические соединения в быту. Понятие о бытовых химикатах Понятие о сплавах и методах их получения
Понятие о сплавах и методах их получения Фуллерены
Фуллерены Вспомогательные средства для стирки
Вспомогательные средства для стирки Кристаллическая структура вещества. Вывод формульных единиц по отношению масс элементов и по массовым долям элементов. (Урок №6)
Кристаллическая структура вещества. Вывод формульных единиц по отношению масс элементов и по массовым долям элементов. (Урок №6) Получение металлов в промышленности. Чёрная металлургия
Получение металлов в промышленности. Чёрная металлургия Химическая кинетика
Химическая кинетика Алотропия углерода
Алотропия углерода Производство метанола
Производство метанола Классификация и номенклатура органических соединений. Гибридизация атома С, химические связи
Классификация и номенклатура органических соединений. Гибридизация атома С, химические связи Характеристика химического элемента-неметалла на основании его положения в ПСХЭ Д.И.Менделеева. 9 класс
Характеристика химического элемента-неметалла на основании его положения в ПСХЭ Д.И.Менделеева. 9 класс