Слайд 2Задачи урока:
Познакомиться с понятиями кислые, средние, основные соли

Слайд 3Свойства оснований.
А) P2O5 + 6KOH = 2K3PO4 + 3H2O
P2O5 + 6K+ +

6OH- = 6K+ + 2PO43- + 3H2O
P2O5 + 6OH- = 2PO43- + 3H2O
Б) Fe(OH)2 + 2HNO3 = Fe(NO3)2 + 2H2O
Fe(OH)2 + 2H++2NO3- =Fe2+ + 2NO3- + 2H2O
Fe(OH)2 + 2H+ =Fe2+ + 2H2O
Слайд 4Свойства оснований.
В)(NH4)2SO4 + 2NaOH =Na2SO4+ 2NH3+ 2H2O
2NH4+ +SO42-+2Na++2OH- =2Na+ +2SO42-+ 2NH3+ 2H2O
2NH4+

+2OH- = 2NH3+ 2H2O
Г) Ca(OH)2 + CO2 = CaCO3 + H2O
Ca2+ + 2OH- + CO2 = CaCO3 + H2O
Слайд 5Свойства оснований.
Д) 3Ba(OH)2+2Fe(NO3)3=3Ba(NO3)2+ 2Fe(OH)3
3Ba2+ +6OH- +2Fe3+ +6NO3- =3Ba2++6NO3- + 2Fe(OH)3
6OH- +2Fe3+ =

2Fe(OH)3
3OH- +Fe3+ = Fe(OH)3
З) 2CuOH = Cu2O + H2O
Слайд 6Отметьте знаком «+» те случаи, когда между веществами возможно взаимодействие
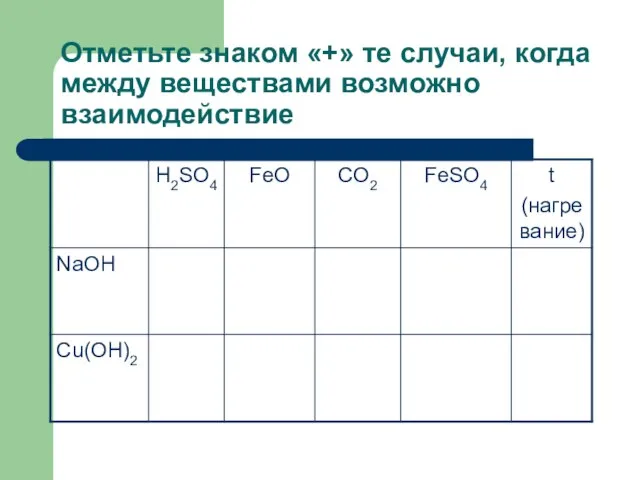
Слайд 7Отметьте знаком «+» те случаи, когда между веществами возможно взаимодействие
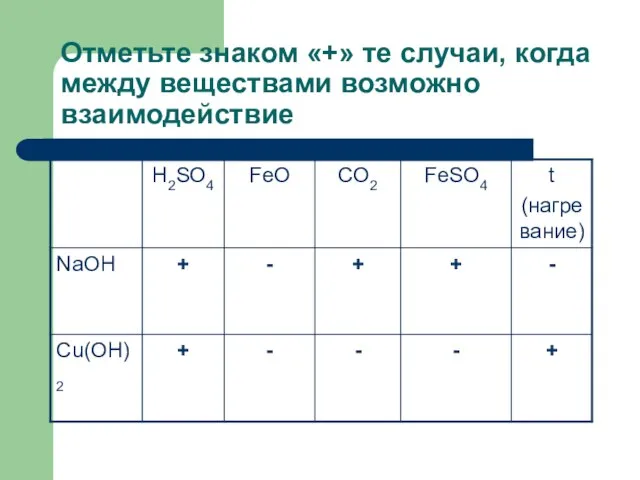
Слайд 8Определите химический элемент
1) 11p, 10n, 11e
2) 6p, 6n, 6e
3) 11p, 12n, 11e

Слайд 9Классификация солей
NaOH =Na+ + OH-
H2SO4 = H+ + HSO4-
HSO4- = H+
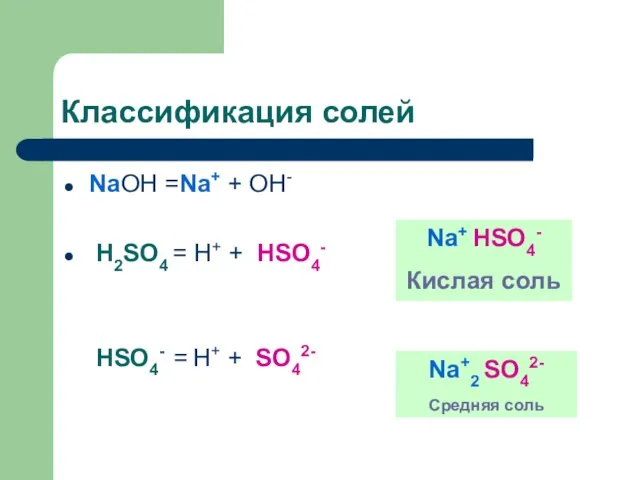
+ SO42-
Na+ HSO4-
Кислая соль
Na+2 SO42-
Средняя соль
Слайд 10Классификация солей
Вa(OH)2 = Вa(OH)+ + OH-
Вa(OH)- = Вa2+ + OH-
HCl =
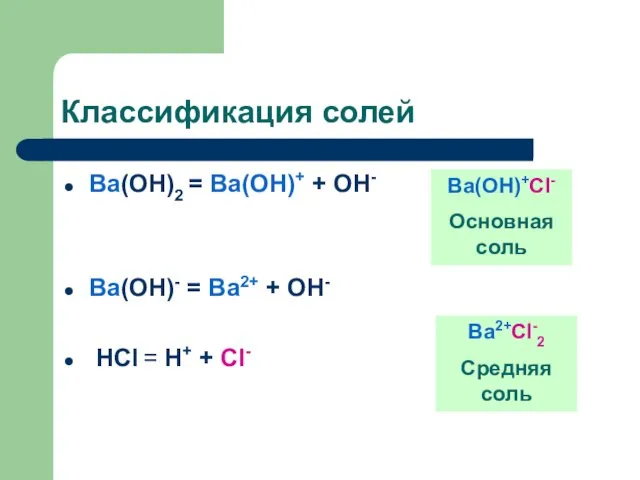
H+ + Cl-
Вa(OH)+Cl-
Основная соль
Вa2+Cl-2
Средняя соль
Слайд 11Классификация солей
Запишите формулы солей и уравнения диссоциации:
гидросульфата калия
гидрокарбоната кальция
Какие

кислоты не могут образовывать кислых солей?
Многоосновные кислоты способны образовывать кислые соли.
Слайд 12Классификация солей
Запишите формулы солей и уравнения диссоциации:
гидроксонитрата кальция
гидроксохлорида магния
Какие

основания не могут образовывать основных солей?
Многокислотные основания способны образовывать основные соли.
Слайд 13Выполните упражнение №2, стр.147
KHCO3
(CuOH)2CO3
BaSO4
AlOHCl2
Ca(HPO4)2
Ba(HSO4)2
Na3PO4

Слайд 14Выводы:
1. Соли – это ….
По составу различают соли: ….., ….., ….. .














 Минерал гранат
Минерал гранат Составитель: Денисова В.Г.
Составитель: Денисова В.Г. Разнообразие жизни на Земле - Презентация_
Разнообразие жизни на Земле - Презентация_ Роль катализа в жизнедеятельности организма. Ферментативный катализ. Классификация ферментов
Роль катализа в жизнедеятельности организма. Ферментативный катализ. Классификация ферментов Железо в продуктах питания. Подготовила ученица 9 «б» класса Чиженькова Ольга. Учитель: Шарапова О. В.
Железо в продуктах питания. Подготовила ученица 9 «б» класса Чиженькова Ольга. Учитель: Шарапова О. В. Перекрывающиеся гены
Перекрывающиеся гены Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона
Влияние пластифицирующих добавок на свойства декоративного мелкозернистого бетона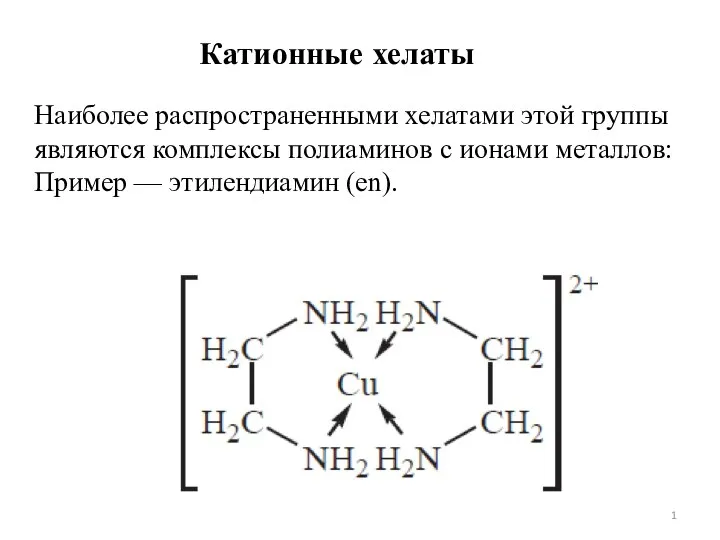 Хелатный эффект. Лекция 7
Хелатный эффект. Лекция 7 Кислоты
Кислоты Полимеры
Полимеры Презентация на тему Химический алфавит
Презентация на тему Химический алфавит  Vodík
Vodík Химическая связь
Химическая связь Химия. (Задачи)
Химия. (Задачи)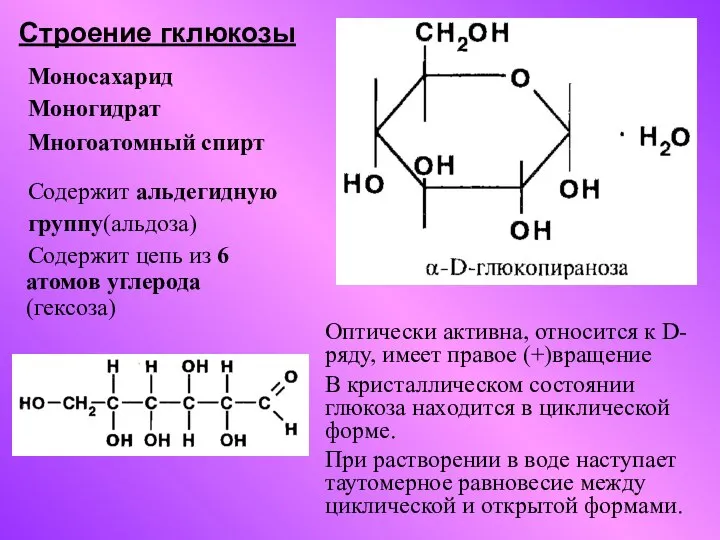 Строение гклюкозы
Строение гклюкозы Смеси и взвеси веществ. Простейшие операции с веществом
Смеси и взвеси веществ. Простейшие операции с веществом Химический элемент. Изотопы. Ионы
Химический элемент. Изотопы. Ионы Анилин (амидобензол, аминобензол, фениламин)
Анилин (амидобензол, аминобензол, фениламин) Спирты. Тест
Спирты. Тест Упражнения. Масс-спектрометрия
Упражнения. Масс-спектрометрия Химические свойства основных оксидов. 9 класс
Химические свойства основных оксидов. 9 класс Алкадиены. Закрепление пройденного материала
Алкадиены. Закрепление пройденного материала Бордос сұйықтығын дайындау және оның сапасын тексеру
Бордос сұйықтығын дайындау және оның сапасын тексеру Винная кислота
Винная кислота Углерод и его свойства
Углерод и его свойства Научно-познавательное шоу Юный химик
Научно-познавательное шоу Юный химик Строение электронных оболочек атомов элементов малых периодов
Строение электронных оболочек атомов элементов малых периодов Коррозия металлов
Коррозия металлов