Содержание
- 2. Щёлочноземельные металлы-элементы IIA группы Щелочноземельными являются не все элементы IIА группы, а только начиная с кальция
- 3. Ве - металл, которому соответствуют амфотерный оксид и гидроксид Mg – металл, Сa, Sr,Ba - щёлочноземельные
- 4. Общая характеристика элементов главной подгруппы II группы
- 5. Общая характеристика элементов главной подгруппы II группы Одинаковое строение внешнего электронного слоя Элементы проявляют ст.ок. +2
- 6. Магниевая горная порода – магнезит. Нахождение в природе Как активные металлы, они встречаются в природе только
- 7. Бериллий Магний Кальций Стронций Барий Радий
- 8. 25.11.20 Щелочные металлы легкие, мягкие и легкоплавкие, серебристы, стронций имеет золотистый оттенок. Стронций - ковкий Физические
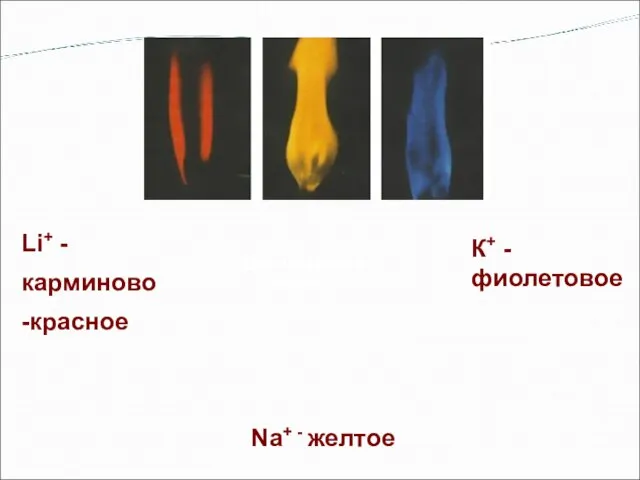
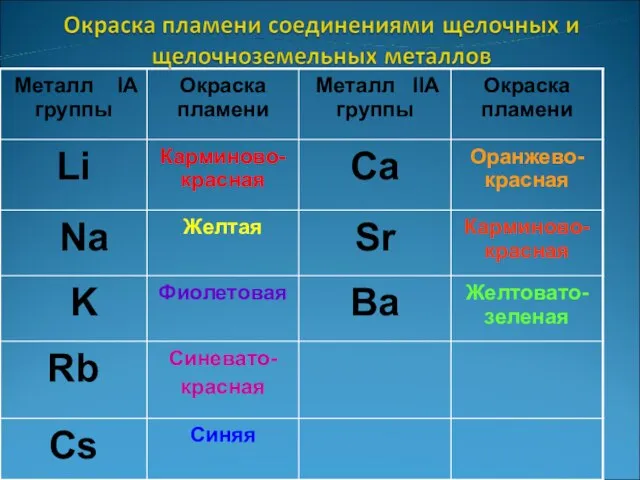
- 9. Окрашивание пламени К+ - фиолетовое Na+ - желтое Li+ - карминово -красное
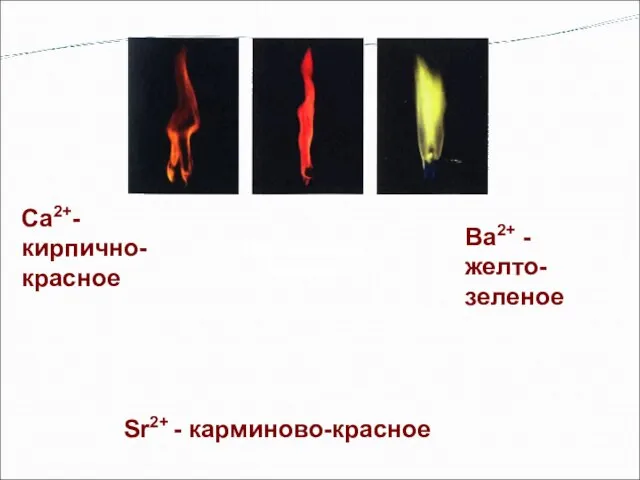
- 10. Окрашивание пламени Са2+- кирпично-красное Sr2+ - карминово-красное Bа2+ - желто- зеленое
- 12. РАЗДЕЛ: Соли элементов IIA группы
- 14. Химические свойства элементов IIА группы Взаимодействуют с простыми веществами
- 15. 25.11.20 Химические свойства 1. Металлы взаимодействуют почти со всеми неметаллами: 2Ме0 + О20 =2Ме+2О-2 (оксид) Ме0
- 16. Взаимодействие с кислотами Все взаимодействуют с хлороводородной и разбавленной серной кислотами с выделением водорода: Be +
- 17. Взаимодействие со щелочами Бериллий взаимодействует с водными растворами щелочей: Be + 2NaOH + 2H2O = Na2[Be(OH)4]
- 18. Как и алюминий, Mg и Са способны восстанавливать редкие металлы из их оксидов: 2Mg+TiO2=2MgO + Ti
- 19. Проверь себя (работа с таблицей Д.И. Менделеева) Сравните атомы элементов, поставив знаки или = вместо *:
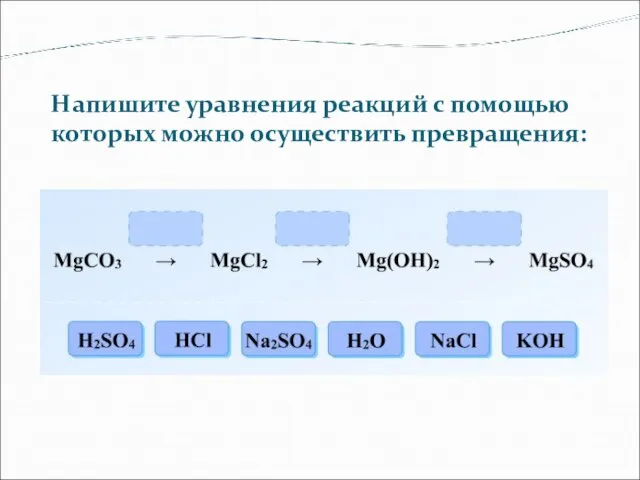
- 20. Напишите уравнения реакций с помощью которых можно осуществить превращения:
- 22. Скачать презентацию















 Химическая связь и строение вещества
Химическая связь и строение вещества lektsia_6 (1)
lektsia_6 (1) Основы квантовой химии
Основы квантовой химии Презентация по Химии "Законы газового состояния вещества"
Презентация по Химии "Законы газового состояния вещества"  Алканы
Алканы Эксперимент с духами
Эксперимент с духами Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли
Доказательство амфотерности аминокислот. Продукты, содержащие аминокислоты и их соли Презентация на тему "Азотная кислота"
Презентация на тему "Азотная кислота" Что такое электрон?
Что такое электрон? Химия — это наука о веществах, их свойствах и превращениях
Химия — это наука о веществах, их свойствах и превращениях Цикл фосфора (окончание). Цикл в реках и в море
Цикл фосфора (окончание). Цикл в реках и в море Производные салициловой, пара-аминобензойной кислот, применяемые в медицине
Производные салициловой, пара-аминобензойной кислот, применяемые в медицине Виды химических связей
Виды химических связей Влияние различных факторов на скорость химических реакций
Влияние различных факторов на скорость химических реакций Валентность
Валентность Азотосодержащие соединения: Амины. Аминокислоты. Белки
Азотосодержащие соединения: Амины. Аминокислоты. Белки Щелочные металлы и их соединения
Щелочные металлы и их соединения Природные источники углеводородов. Нефть и природный газ
Природные источники углеводородов. Нефть и природный газ Ископаемые углеводороды
Ископаемые углеводороды Элемент астат
Элемент астат Кристаллы. Виды
Кристаллы. Виды Строение атома. Связь основных характеристик атома с его положением в таблице Д.И. Менделеева. Способы изображения строения
Строение атома. Связь основных характеристик атома с его положением в таблице Д.И. Менделеева. Способы изображения строения Классификация химических реакций
Классификация химических реакций КВН по теме: Периодическая система химических элементов Д.И. Менделеева
КВН по теме: Периодическая система химических элементов Д.И. Менделеева Введение в органическую химию
Введение в органическую химию Онлайн-школа подготовки к ЕГЭ по химии CharChem
Онлайн-школа подготовки к ЕГЭ по химии CharChem Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро
Амфотерные соединения Амфотерными называют соединения, которые в зависимости от условий могут быть как донорами катионов водоро Соли. Для учащихся 8 класса
Соли. Для учащихся 8 класса