масса 1.00794. Химический символ водорода Н читается в нашей стране «аш», как Химический элемент водород.
Природный водород состоит из смеси двух стабильных нуклидов с массовыми числами 1,007825 (99,985 % в смеси) и 2,0140 (0,015 %). Кроме того, в природном водороде всегда присутствуют ничтожные количества радиоактивного нуклида — трития 3Н (период полураспада Т1/212,43 года). Так как в ядре атома водорода содержится только 1 протон (меньше в ядре атома элемента протонов быть не может), то иногда говорят, что водород образует естественную нижнюю границу периодической системы элементов Д. И. Менделеева (хотя сам элемент водород расположен в самой верхней части таблицы). Элемент водород расположен в первом периоде таблицы Менделеева. Его относят и к 1-й группе (группе IА щелочных металлов), и к 7-й группе (группе VIIA галогенов).
Химический элемент





 Гранулометричний склад матеріалу і його характеристики
Гранулометричний склад матеріалу і його характеристики Входное тестирование по химии
Входное тестирование по химии Electrochemical properties of arylsilanes
Electrochemical properties of arylsilanes Алкадиены, каучуки
Алкадиены, каучуки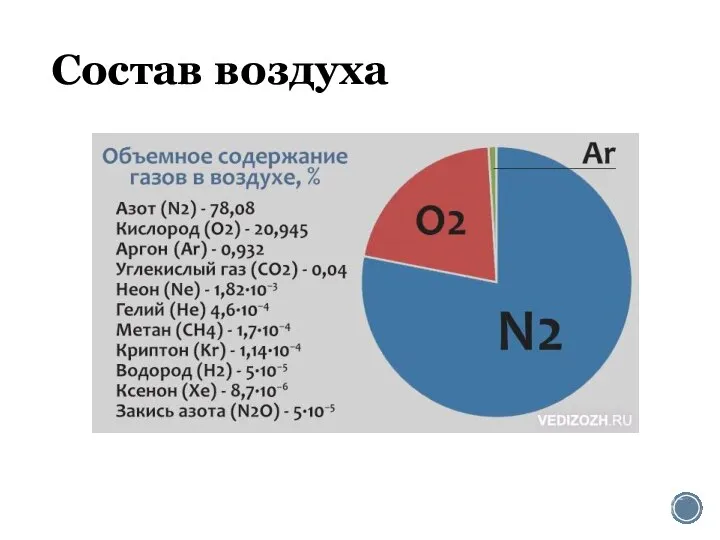 Состав воздуха. Азот
Состав воздуха. Азот Химическая формула
Химическая формула Обобщение и систематизация знаний по теме Углеводороды
Обобщение и систематизация знаний по теме Углеводороды Распределение электронов в атомах
Распределение электронов в атомах 01_Khimicheskiy_sostav
01_Khimicheskiy_sostav Гидролиз солей
Гидролиз солей Ароматические углеводороды. Бензол Презентация выполнена учителем химии лицея №1 пос. Львовский Подольского района Воробьёвой
Ароматические углеводороды. Бензол Презентация выполнена учителем химии лицея №1 пос. Львовский Подольского района Воробьёвой Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа
Аттестационная работа. Сколько наша семья потребляет энергоресурсов и выбрасывает углекислого газа Промышленный биокатализ
Промышленный биокатализ Номенклатура и изомерия алкенов
Номенклатура и изомерия алкенов ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА АЛКИНОВ Дисперсные системы и поверхностные явления
Дисперсные системы и поверхностные явления Получение и применение алкадиенов
Получение и применение алкадиенов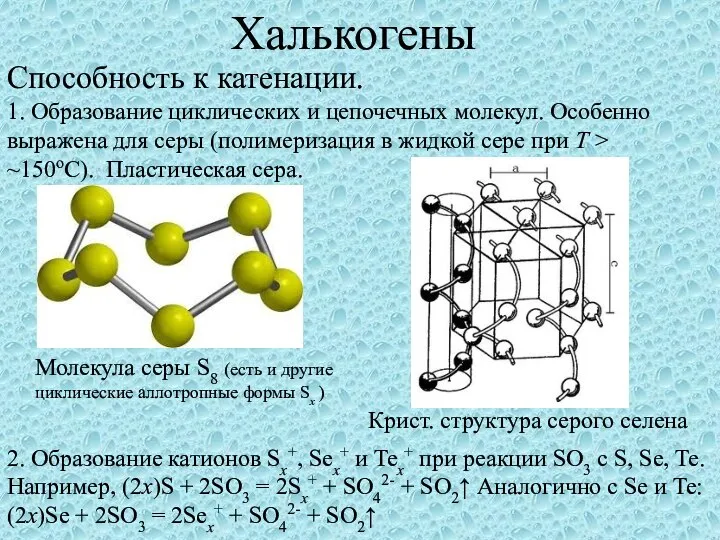 Халькогены. Способность к катенации
Халькогены. Способность к катенации Положение галогенов в Периодической системе Д.И. Менделеева
Положение галогенов в Периодической системе Д.И. Менделеева Классификация органических соединений. Предельные углеводороды (УВ)
Классификация органических соединений. Предельные углеводороды (УВ) Биогенный элемент. Кобальт (Со)
Биогенный элемент. Кобальт (Со) Вяжущие вещества
Вяжущие вещества Фторсодержащие полимеры
Фторсодержащие полимеры Презентация на тему Все о спиртах
Презентация на тему Все о спиртах  Скорость химической реакции
Скорость химической реакции Спирт – это жизненная необходимость или страшное зло…
Спирт – это жизненная необходимость или страшное зло… Презентация на тему Альдегиды и Кетоны
Презентация на тему Альдегиды и Кетоны  Нефть и основные продукты её переработки
Нефть и основные продукты её переработки