Содержание
- 2. Маленькая точка, сделанная карандашом, состоит из огромного количества атомов, большего, чем количество жителей на Земле!
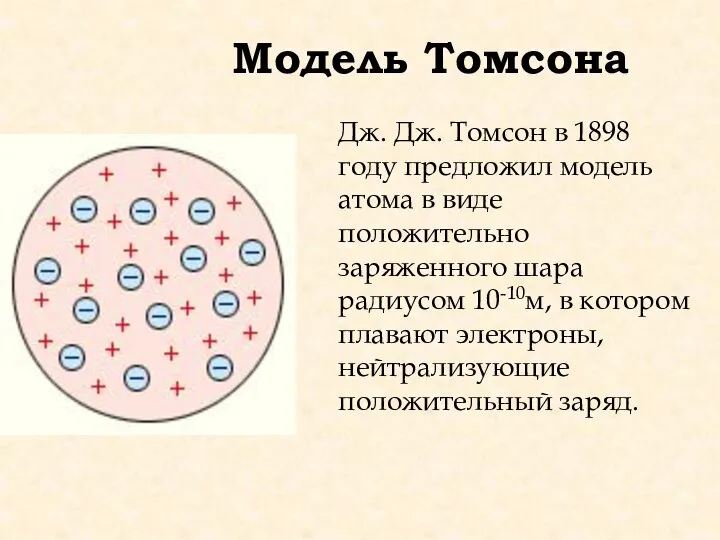
- 3. Модель Томсона Дж. Дж. Томсон в 1898 году предложил модель атома в виде положительно заряженного шара
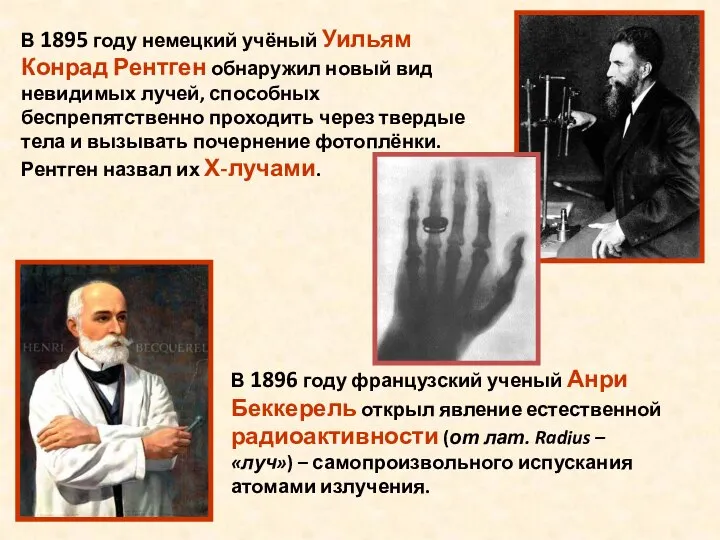
- 4. В 1895 году немецкий учёный Уильям Конрад Рентген обнаружил новый вид невидимых лучей, способных беспрепятственно проходить
- 5. В 1898 году Пьер Кюри и Мария Склодовская – Кюри, изучавшие явление радиоактивности, открыли новые элементы
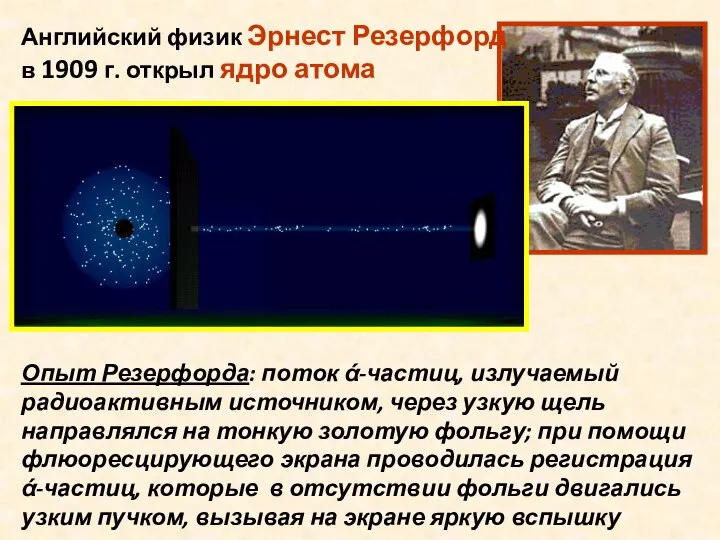
- 6. Английский физик Эрнест Резерфорд в 1909 г. открыл ядро атома Опыт Резерфорда: поток ά-частиц, излучаемый радиоактивным
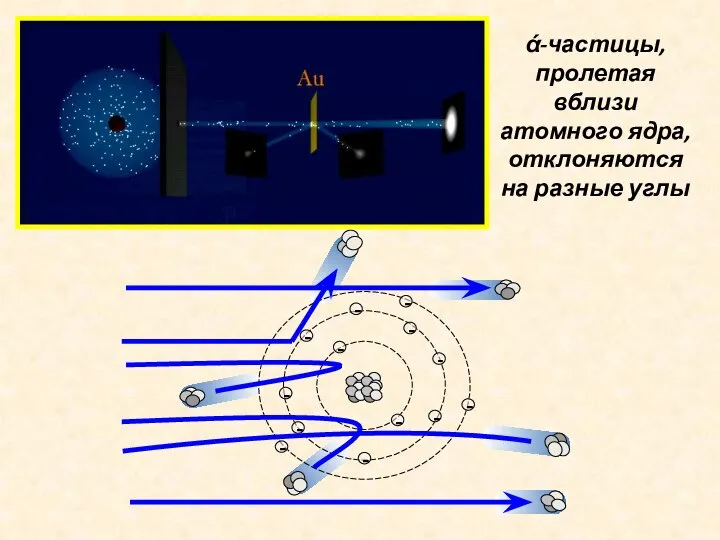
- 7. ά-частицы, пролетая вблизи атомного ядра, отклоняются на разные углы
- 8. Э. Резерфорд предложил планетарную модель атома: в центре находится положительно заряженное ядро, которое имеет достаточно малые
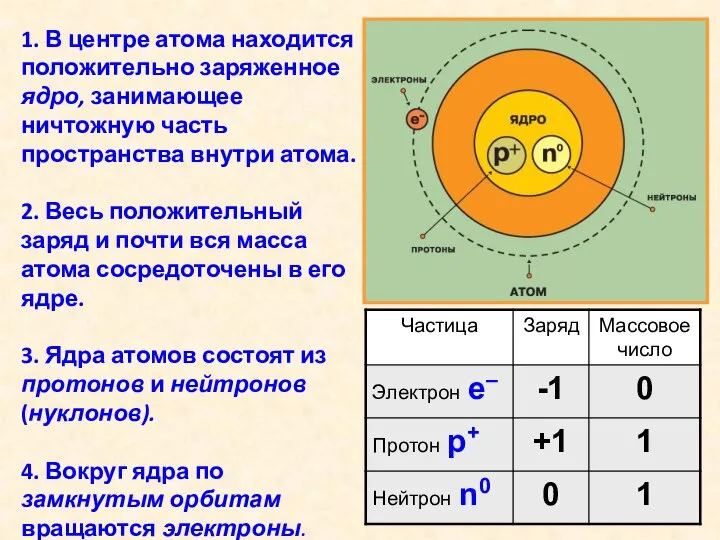
- 9. 1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома. 2. Весь
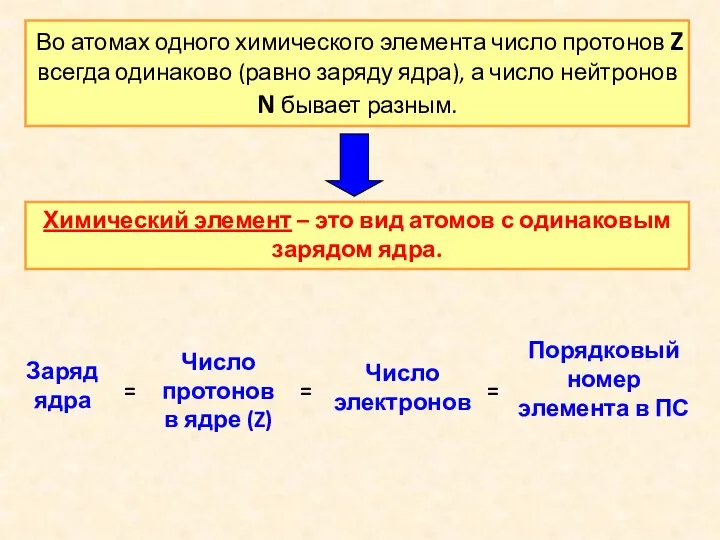
- 10. Во атомах одного химического элемента число протонов Z всегда одинаково (равно заряду ядра), а число нейтронов
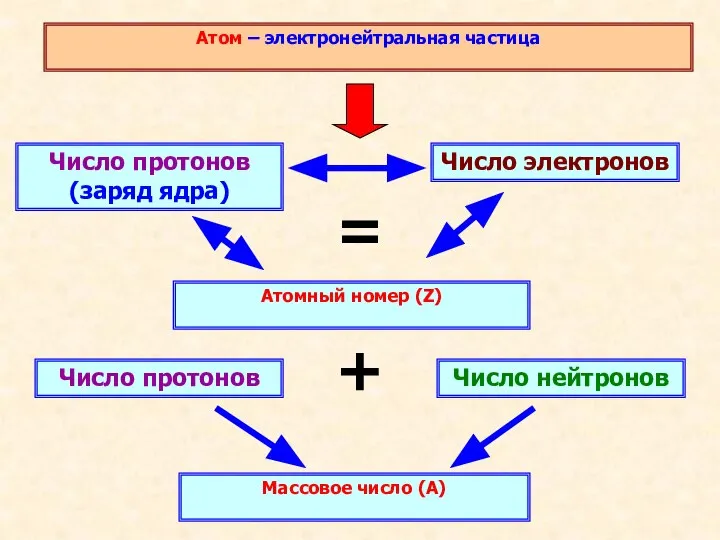
- 11. Атом – электронейтральная частица Число протонов (заряд ядра) Атомный номер (Z) Число электронов = Число нейтронов
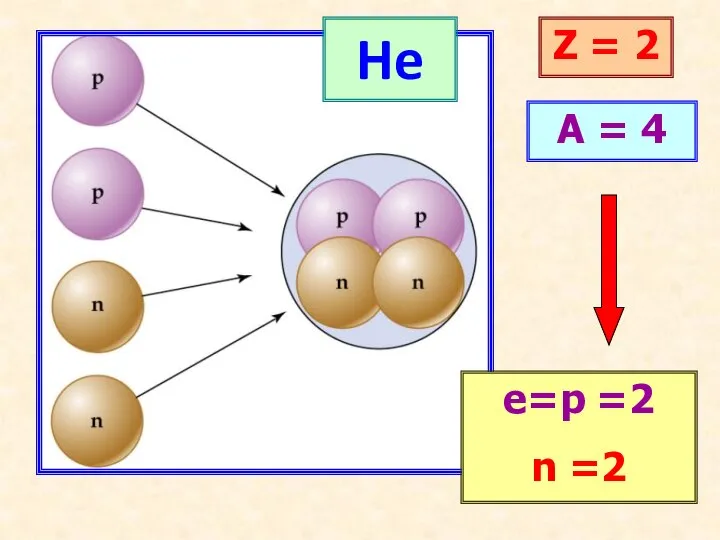
- 12. He Z = 2 A = 4 е=p =2 n =2
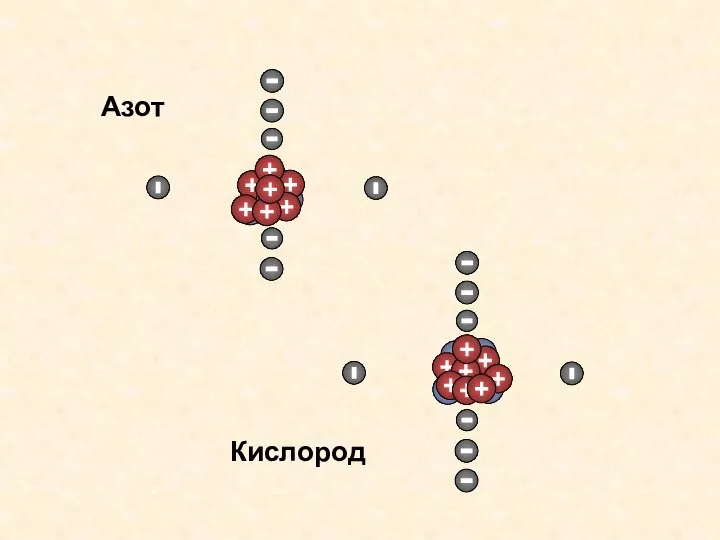
- 13. Кислород Азот
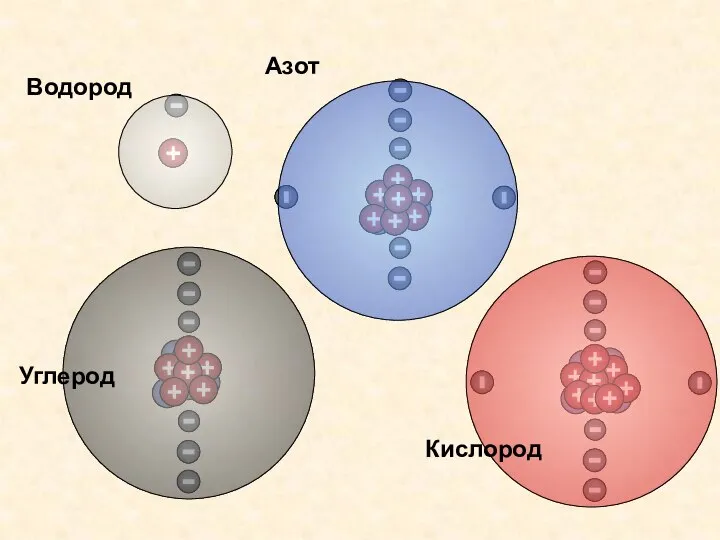
- 14. Водород Азот Кислород Углерод
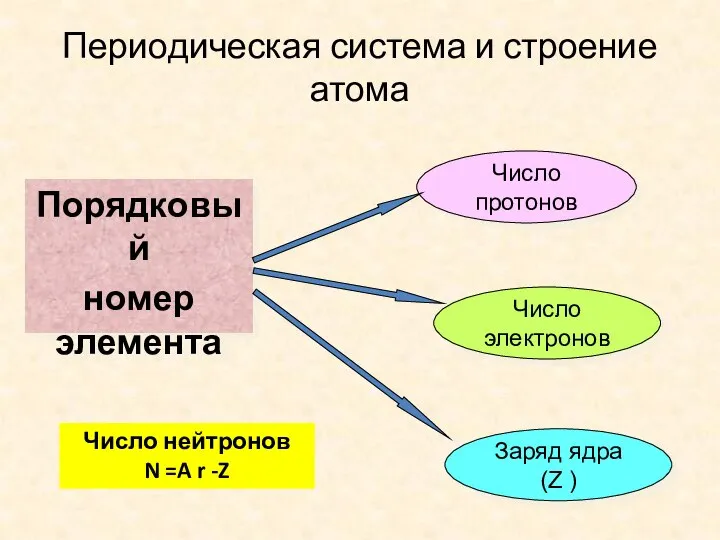
- 15. Периодическая система и строение атома Порядковый номер элемента Число протонов Число электронов Заряд ядра (Z )
- 16. Заполни таблицу
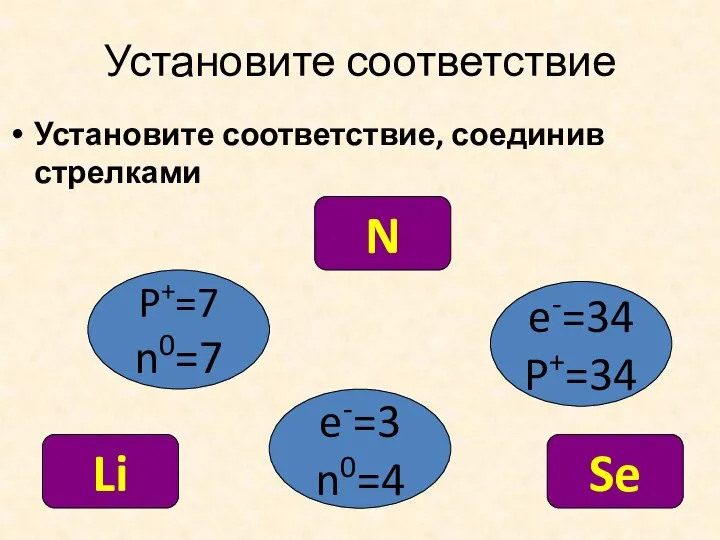
- 17. Установите соответствие Установите соответствие, соединив стрелками P+=7 n0=7 e-=34 P+=34 e-=3 n0=4 N Se Li
- 18. Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от зарядов атомных ядер
- 19. Тестовые задания Заряд ядра атома азота равен : а) 7 б) 13 в) 4 г) 29
- 20. Тестовые задания Заряд ядра атома азота равен : а) 7 б) 13 в) 4 г) 29
- 21. Домашнее задание п. 37 упр 1-3 стр. 138
- 23. Скачать презентацию








 Study of short peptide adsorption on solution dispersed. Inorganic nanoparticles using depletion method
Study of short peptide adsorption on solution dispersed. Inorganic nanoparticles using depletion method Диссоциация. Уравнения диссоциации
Диссоциация. Уравнения диссоциации Порядковый номер элемента. Изотопы
Порядковый номер элемента. Изотопы Карбоновые кислоты
Карбоновые кислоты Вторичная переработка нефти. Крекинг
Вторичная переработка нефти. Крекинг Соли. 8 класс
Соли. 8 класс Образование раствора
Образование раствора Альдегиды
Альдегиды Общая характеристика галогенов. 9 класс
Общая характеристика галогенов. 9 класс Циклические эфиры (окиси)
Циклические эфиры (окиси) Алкены. Непредельные углеводороды, олефины
Алкены. Непредельные углеводороды, олефины Строение и свойства металлов. Материаловедение. Лекция 1
Строение и свойства металлов. Материаловедение. Лекция 1 Квест Секретная лаборатория. Первоначальные химические понятия. 8 класс
Квест Секретная лаборатория. Первоначальные химические понятия. 8 класс Основные виды сырья для промышленности органического и нефтехимического синтеза
Основные виды сырья для промышленности органического и нефтехимического синтеза Разминка для болельщиков
Разминка для болельщиков alkany_alkeny_alkiny_
alkany_alkeny_alkiny_ Азотосодержащие органические соединения
Азотосодержащие органические соединения Водород. Свойства, применение
Водород. Свойства, применение Реакции ионного обмена и условия их протекания
Реакции ионного обмена и условия их протекания Нефть и продукты ее переработки. Лабораторная работа
Нефть и продукты ее переработки. Лабораторная работа Soft Matter. Emulsions
Soft Matter. Emulsions Спирты. Классификация
Спирты. Классификация Свободные атомы. Простые вещества. Сложные вещества
Свободные атомы. Простые вещества. Сложные вещества Стекло. Виды стекла
Стекло. Виды стекла Вода. Общие сведения
Вода. Общие сведения Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Электролитическая диссоциация. Электролиты и неэлектролиты
Электролитическая диссоциация. Электролиты и неэлектролиты Химия нефти и газа
Химия нефти и газа