Содержание
- 2. Требования к знаниям и умениям знать правила определения степеней окисления в различных соединениях знать понятия ОВР,
- 3. Одной из важнейших характеристик химического элемента, входящего в состав вещества является его степень окисления. Степень окисления
- 4. Рассмотрим применение этого правила на простых примерах. Пример 1. Необходимо найти степени окисления элементов в аммиаке
- 5. Пример 1. Необходимо найти степени окисления элементов в аммиаке (NH3). Решение. 1) Обозначим известную с. о.
- 6. Пример 3. Рассчитайте степени окисления всех элементов в молекуле Al(NO3)3. Решение. Алгоритм остается неизменным. В состав
- 7. Рассчитайте степени окисления всех элементов : MnO2 , Na2SO3, Zn, FeCl3, Cr3N2 , O3 , CoSO4,(NH4)3PO4
- 8. Проверьте себя. Где вы сделали ошибку? Почему? Mn+4O2-2 Na+2S+4O-23 Zn0 Fe+3 Cl3 O03 Cr+23N-3 2 Co+2S+6O-24
- 9. Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными (ОВР).
- 10. Проверьте себя Fe+3(O-2H+)3 + H+Cl- → Fe+3Cl-3 + H+2O-2 H+2S-2 + O02 → H+2O-2 + S+4O-22
- 11. Окисление —это процесс, в котором элемент теряет свои электроны. Элемент, который теряет электроны и повышает степень
- 12. Восстановление — это процесс, в котором элемент присоединяет электроны. Элемент, который присоединяет электроны и понижает степень
- 13. По изменению степени окисления определите сколько электронов атом принял или потерял. Обозначьте: где происходит процесс окисления,
- 14. Рассмотрите схему и сделайте вывод: Как зависят окислительные и восстановительные свойства от степени окисления элементов? S-2
- 15. Сера (-2) теряет электроны, т.е. проявляет восстановительные свойства, она не может принять электроны и быть окислителем:
- 16. Вывод: Окислительные и восстановительные свойства элементов и их соединений зависят и от свойств элемента и от
- 17. Определите какие ОВ свойства будут характерны для элементов: Мg0 Cu+2 Al+3 Cl0 Sb+5 N-3 N+2
- 18. Алгоритм расстановки коэффициентов в уравнениях ОВР методом электронного баланса. 1) Запишите схему реакции (формулы исходных веществ
- 19. Алгоритм расстановки коэффициентов в уравнениях ОВР методом электронного баланса. (продолжение) 8) Определить коэффициенты (разделив поочередно наименьшее
- 20. Электронный баланс в ОВР Zn + 2HCl = ZnCl2 + H2 +1 0 -1 -1 0
- 21. Пользуясь алгоритмом, определите степени окисления элементов; укажите окислитель и восстановитель; расставьте коэффициенты в ОВР методом электронного
- 22. Значение ОРВ Окислительно-восстановительные процессы сопровождают круговороты веществ в природе. С ними связаны процессы брожения, и гниения,
- 23. Применение ОВР Получение оксидов и других соединений в неорганическом и органическом синтезе; Получение металлов из их
- 24. Обычно в ОВР передача электронов восстановителями окислителям происходит при непосредственном контакте частиц, и энергия химической реакции
- 25. Если металлическую пластину (электрод) опустить в водный раствор, то на границе металл-раствор будут происходить химические процессы.
- 26. Электродные потенциалы металлов были измерены при определенных (стандартных) условиях относительно нормального водородного электрода (его потенциал принят
- 27. Гальванический элемент Даниеля-Якоби.
- 28. Электродные потенциалы металлов
- 29. Определить электродные потенциалы можно для любого ОВ процесса. Стандартные окислительно-восстановительные потенциалы представлены в таблицах специальных справочников.
- 32. Величина и знак стандартных окислительно-восстановительных потенциалов, позволяют 1) предсказать какие ОВ свойства будут проявлять атомы, ионы
- 33. Алгоритм определения возможности протекания ОВР По таблице потенциалов определить потенциал окислителя и восстановителя. Во всех справочниках
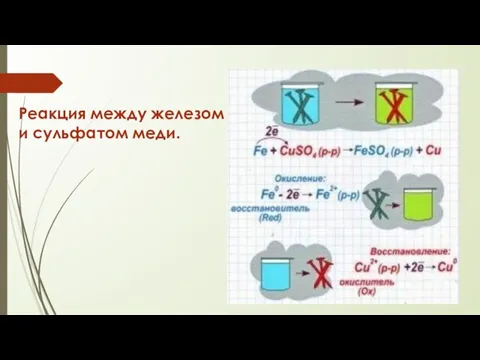
- 34. Реакция между железом и сульфатом меди.
- 35. Возможна ли ОВР между веществами (при с.у) Допишите уравнения возможных реакций. 1) Zn + HCl →
- 36. Электролиз — окислительно-восстановительные реакции, которые осуществляются на электродах при пропускании электрического тока через расплав или раствор
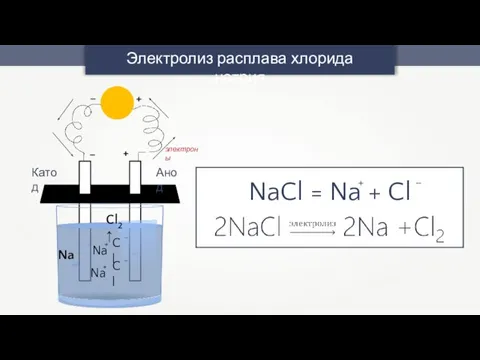
- 37. Электролиз расплава хлорида натрия + – + – Анод Катод Cl2↑ Na электроны
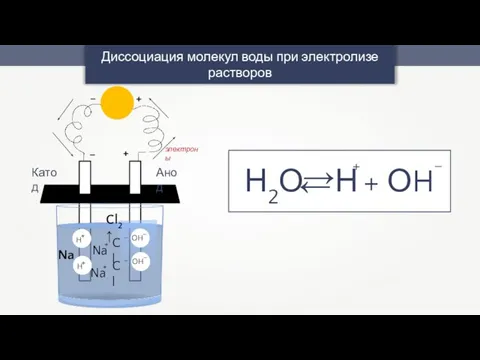
- 38. Диссоциация молекул воды при электролизе растворов Н2О Н + ОH + – + – + –
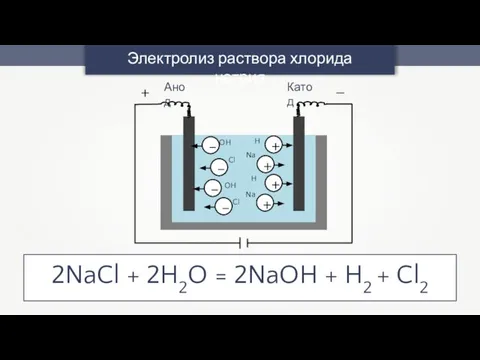
- 39. Электролиз раствора хлорида натрия OH OH Cl Na Na Cl H H Анод Катод + –
- 41. Скачать презентацию


































 Практическая работа 1. ХТП. Классификация химических реакций
Практическая работа 1. ХТП. Классификация химических реакций Пакет заданий №2. Команда вечерний дозор
Пакет заданий №2. Команда вечерний дозор Ароматические углеводороды
Ароматические углеводороды Алкины
Алкины Азотсодержащие гетероциклические соединения пиррол
Азотсодержащие гетероциклические соединения пиррол Влияние метилового спирта на организм человека
Влияние метилового спирта на организм человека Презентация на тему Эфиры и жиры
Презентация на тему Эфиры и жиры  Химическая связь
Химическая связь Практико-ориентировочный проект Оксиды на службе у человека
Практико-ориентировочный проект Оксиды на службе у человека Альдегиды. Состав. Строение. Свойства. Применение
Альдегиды. Состав. Строение. Свойства. Применение Внеклассное мероприятие по химии для учащихся 8 классов
Внеклассное мероприятие по химии для учащихся 8 классов Алюминий
Алюминий Спирты или алканолы
Спирты или алканолы Фосфор. История открытия фосфора
Фосфор. История открытия фосфора 1_Galogeny
1_Galogeny Подготовка к контрольной работе по теме «Изменения, происходящие с веществами
Подготовка к контрольной работе по теме «Изменения, происходящие с веществами Особенности строения алкенов
Особенности строения алкенов Алкены
Алкены Великие русские химики
Великие русские химики Физические свойства алкенов
Физические свойства алкенов Химические свойства воды
Химические свойства воды Жиры (липиды)
Жиры (липиды) Многоэлектронные атомы
Многоэлектронные атомы Скорость химической реакции
Скорость химической реакции Оксиды и гидроксиды металлов
Оксиды и гидроксиды металлов Введение в хроматографию. Хроматографические методы анализа
Введение в хроматографию. Хроматографические методы анализа Физическая химия тугоплавких неметаллических и силикатных материалов (ТНСМ)
Физическая химия тугоплавких неметаллических и силикатных материалов (ТНСМ) Трансжиры и их анализ
Трансжиры и их анализ