Содержание
- 2. Вспомним! Что называется: Оксидами Основаниями Кислотами
- 3. Назовите вещества Na2O CaO Al2О3 P2O5 NaOH Ca(OH)2 Al(OH)3 HCl HNO3 H2S H2SO4 H3PO4
- 4. Выберите отдельно кислоты, основания, соли CaO Ca(OH)2 HNO3 Al2(SO4)3 H3PO4 CO2 H2S NaCl Mg(OH)2 CaCO3
- 5. Назовите соли MgSO4 Al2(SO4)3 Fe(NO3)3 CaCO3 NaCl
- 6. Напишите формулы Хлорид магния Сульфат калия Нитрат алюминия Фосфат цинка
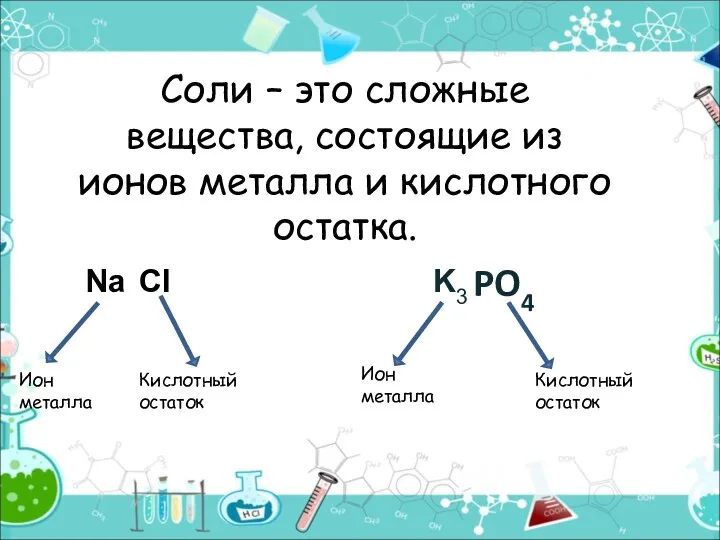
- 7. Соли – это сложные вещества, состоящие из ионов металла и кислотного остатка. PO4 Ион металла Кислотный
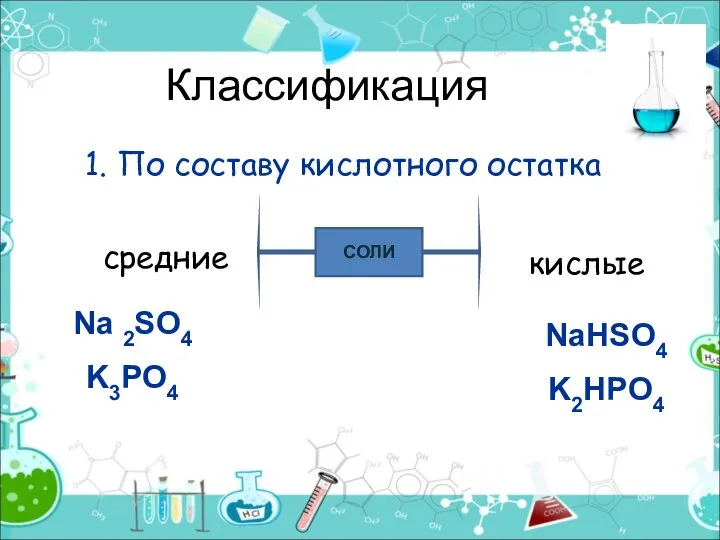
- 8. Классификация 1. По составу кислотного остатка СОЛИ средние кислые Na 2SO4 K3PO4 NaHSO4 K2HPO4
- 9. Номенклатура средних солей магния Название кислотного остатка Наименование металла в родительном падеже МgСL2 хлорид
- 10. Номенклатура кислых солей Указать название кислотного остатка К названию кислотного остатка прибавить «гидро-» Наименование металла в
- 11. Химические свойства 1. Взаимодействие с металлами: SnCl2 + Zn ? ZnCl2 + Sn
- 12. Химические свойства 2. Взаимодействие со щелочами: 2NaОН + CuSO4 → Cu(OH)2 + Na2SO4
- 13. Химические свойства 3. Взаимодействие солей между собой КСl + AgNO3 → AgCl + KNO3
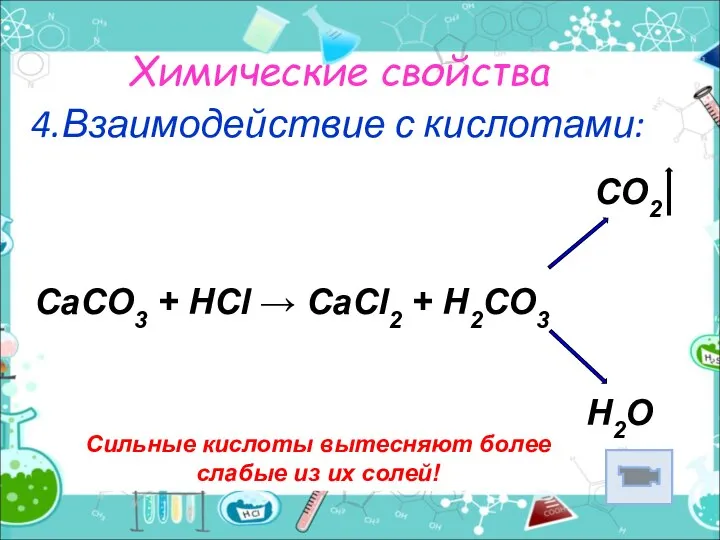
- 14. Химические свойства 4.Взаимодействие с кислотами: Сильные кислоты вытесняют более слабые из их солей! CO2 CaCO3 +
- 15. Химические свойства Разложение при нагревании СаСО3= СО2 + Н2О
- 16. Способы получения 1. Кислота + основание = соль + вода H2SO4 +2NaOH = Na2SO4 + 2H2O
- 17. Способы получения 5. Основание + соль = новое основание + новая соль 2КОН + СаSO4 =
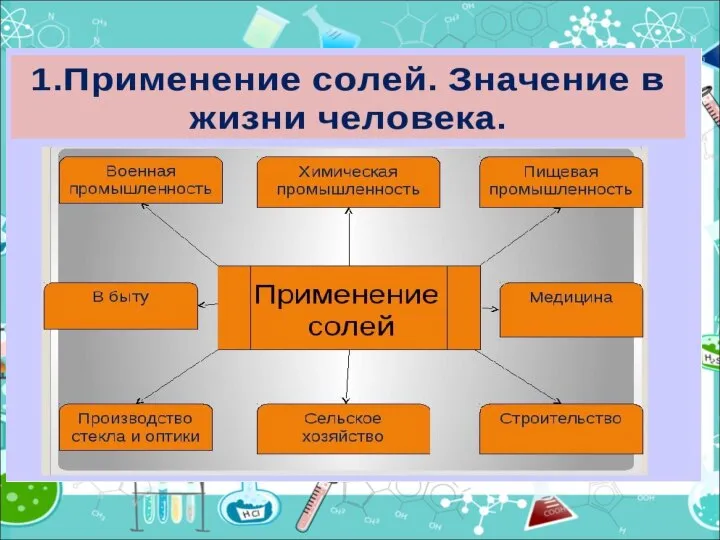
- 20. Скачать презентацию













 Нефть - черное золото
Нефть - черное золото Химический тренажер
Химический тренажер Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи
Количество вещества, число Авогадро, молярная масса, молярный объём, уравнение связи Окислительно- восстановительные реакции
Окислительно- восстановительные реакции Пусть имя Д.И. Менделеева будет нашей путеводной звездой
Пусть имя Д.И. Менделеева будет нашей путеводной звездой Планетарная модель атома и его строение
Планетарная модель атома и его строение Химический канцерогенез
Химический канцерогенез Презентация на тему Строение атома Химическая связь
Презентация на тему Строение атома Химическая связь  Метод нейтрализации
Метод нейтрализации Неметаллические материалы
Неметаллические материалы Химическое равновесие
Химическое равновесие Лабораторные занятия по теме: Методы защиты электрооборудования от коррозии
Лабораторные занятия по теме: Методы защиты электрооборудования от коррозии Аналитический обзор по теме Процесс разложения аммиака
Аналитический обзор по теме Процесс разложения аммиака Сравнительная характеристика NO и NO2 (строение молекул, особенности поведения, устойчивость, ОК свойства)
Сравнительная характеристика NO и NO2 (строение молекул, особенности поведения, устойчивость, ОК свойства) Получение и свойства кислорода. Практическая работа
Получение и свойства кислорода. Практическая работа Карбонат натрия
Карбонат натрия Презентация на тему Кислород О2
Презентация на тему Кислород О2  Принципы строения молекулы дезоксирибонуклеиновой кислоты: комплементарность нуклеотидов
Принципы строения молекулы дезоксирибонуклеиновой кислоты: комплементарность нуклеотидов Простые и сложные вещества
Простые и сложные вещества Презентация на тему ОВР в органической химии
Презентация на тему ОВР в органической химии  Опыты с водой
Опыты с водой Магний (Mg)
Магний (Mg) Строение вещества
Строение вещества Валентность. Определение валентности элемента в оксиде
Валентность. Определение валентности элемента в оксиде Олово и оловоорганические соединения, их свойства и применение
Олово и оловоорганические соединения, их свойства и применение Химия нефти и газа
Химия нефти и газа Предмет органической химии
Предмет органической химии Антидетонационные добавки на основе синергетических смесей оксигенатов к бензиновым топливам
Антидетонационные добавки на основе синергетических смесей оксигенатов к бензиновым топливам